LES Loi de la vitesse de réaction relie la vitesse d'une transformation chimique aux concentrations de réactifs en quantité de matière (mol/L), qui peut s'énoncer comme suit :

Par exemple, considérons la réaction générique suivante :
aA + bB → cC + dD
Disons que nous augmentons la concentration des réactifs A et B, qu'adviendra-t-il de la vitesse de la réaction? Eh bien, comme la quantité de particules réactives augmentera dans le même espace, il y aura des collisions plus efficaces entre elles, ce qui entraînera une augmentation de la vitesse de développement de la réaction. Ce qui signifie que cela augmentera votre vitesse.
Par conséquent, la vitesse de réaction est directement proportionnelle à la concentration des réactifs. Cependant, cela dépend aussi de la température. Par conséquent, nous avons l'équation mathématique suivante qui représente la loi de la vitesse de réaction :

Sur quoi:
v = vitesse de réaction ;
k = constante qui ne dépend que de la valeur de température ;
α et = exposants déterminés expérimentalement.
Ce n'est que lorsque la réaction est élémentaire, c'est-à-dire qu'elle se produit en une seule étape, que les exposants sont exactement égaux aux coefficients de l'équation chimique équilibrée: v = k. [LES]le. [B]B. Cependant, dans d'autres cas, la puissance appropriée à laquelle la concentration de chaque réactif doit être élevée doit être déterminée expérimentalement.
Ne vous arrêtez pas maintenant... Y'a plus après la pub ;)
La loi de la vitesse des réactions porte plusieurs noms, en voici quelques-uns: Loi d'action de masse, équation de rapidité, loi cinétique de réaction et loi de Guldberg-Waage.
Prenons un exemple d'application de cette loi :
Considérons la réaction élémentaire suivante :
2 HCl (g) → H2(g) + Cl2(g)
a) Écris l'équation de la vitesse de cette réaction ;
b) Par des expériences, la vitesse de cette réaction de décomposition du chlorure d'hydrogène gazeux et la concentration de ce réactif, à une température constante de 25 °C, ont été notées dans le tableau ci-dessous :
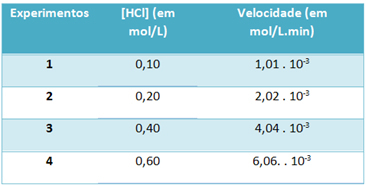
Sur cette base, déterminez la constante de vitesse caractéristique de cette réaction à la température mentionnée.
Résolution:
Le) v = k. [HCl]2
b) v = k. [HCl]2
k = __v___
[HCl]2
k = 1,01. 10-3 mol. L-1. min-1
0,01 mole L-1
k = 1,01. 10-1 min-1
Pour résoudre la lettre "b", vous pouvez utiliser les données de l'une des expériences que la valeur obtenue sera la même.
Mais que faire si la réaction n'est pas élémentaire? Comment sera-t-il possible de résoudre des questions comme celles-ci dans des réactions non élémentaires? Pour savoir comment, lisez la loi de la vitesse pour les réactions non élémentaires.
Par Jennifer Fogaça
Diplômé en Chimie
Souhaitez-vous référencer ce texte dans un travail scolaire ou académique? Voir:
FOGAÇA, Jennifer Rocha Vargas. "Loi de la vitesse des réactions chimiques"; École du Brésil. Disponible en: https://brasilescola.uol.com.br/quimica/lei-velocidade-das-reacoes-quimicas.htm. Consulté le 27 juin 2021.