Toi Hydrocarbures sont composés formés par carbone (C) et hydrogène (H). La flexibilité du carbone, qui est l'élément principal de ces composés, favorise l'existence d'une grande diversité de structures Par conséquent, certaines propriétés, telles que le point de fusion et le point d'ébullition, peuvent différer d'un hydrocarbure à l'autre.
Ce sont surtout des molécules apolaire, avec forces intermoléculaire type de dipôle induit et densité inférieure à le de l'eau. L'identification de ces composés peut se faire grâce à la nomenclature, qui suit les règles établies par l'Union internationale de chimie pure et appliquée (Iupac).
A lire aussi: Carbone - l'un des éléments les plus abondants de l'Univers
Propriétés des hydrocarbures

Polarité: les hydrocarbures sans la présence d'hétéroatomes sont apolaire.
Forces intermoléculaires: les liaisons entre les molécules d'un hydrocarbure sont du type dipôle induit.
point de fusion et et
ébullition: varient selon la taille, la fonction et l'organisation structurelle de la molécule.état physique: dans des conditions normales de température et de pression, les hydrocarbures à quatre atomes de carbone ou moins sont à l'état gazeux. Ceux avec 5 à 17 carbones sont à l'état liquide, et les hydrocarbures avec plus de 17 carbones sont des substances solides.
Densité: est plus petit que le densité d'eau, c'est-à-dire moins de 1,0 g/cm³.
Réactivité: les hydrocarbures aliphatiques et insaturés sont peu réactifs; les composés insaturés sont plus susceptibles de réagir avec d'autres molécules, et les hydrocarbures cycliques contenant jusqu'à cinq carbones sont très réactifs.
Classification des hydrocarbures
Les hydrocarbures peuvent être classés par l'organisation structurelle de la chaîne et par les établissements.Insaturation est la présence de double(s) ou triple liaison entre les carbones, est l'occurrence de connexions de type pi (π). déjà le branches ils sont comme des "branches" attachées à une structure hydrocarbonée plus large. Les chaînes cycliques peuvent également contenir des branches et/ou des insaturations - l'organisation structurelle des hydrocarbures à chaîne fermée forme des polygones tels que carré, triangle, hexane, entre autres.
Concernant l'arrangement des atomes, un hydrocarbure peut avoir une chaîne normale ou ramifiée.
→ C hydrocarbureligne normale, linéaire ou droite: celui avec une chaîne qui n'a que deux extrémités.

→ C hydrocarburedéteste ramifié: celui avec une chaîne qui a plus de deux extrémités. Afin de savoir où et quelles sont les branches, il est important de sélectionner correctement la chaîne principale. La chaîne principale doit contenir toutes les insaturations et hétéroatomes (le cas échéant), aussi bien que le plus grand nombre de carbones séquentiels. Les carbones qui ne sont pas contenus dans la chaîne principale sont des ramifications.
Exemple:

En ce qui concerne sa "fermeture", un hydrocarbure peut avoir une chaîne fermée, ouverte ou mixte.
→ Chaîne d'hydrocarburess fermé ou cyclique : ceux avec des chaînes dans lesquelles les atomes s'organisent en formant un cycle, un polygone ou un cycle aromatique (hydrocarbure fermé à insaturations alternées). Ne pas avoir de bouts libres à moins qu'il y ait une branche. Chaque sommet du polygone représente un carbone et ses agents de liaison hydrogène respectifs.
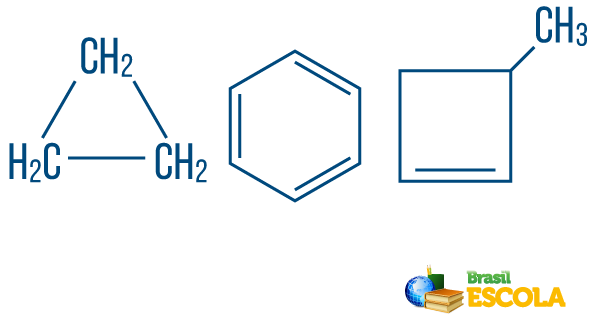
→ Hydrocarbures à chaîne ouverte ou acycliques : sont ceux avec des chaînes qui ont au moins deux extrémités.

→ Hydrocarbure de chaîne de type mixte: est formé par un anneau ou une chaîne cyclique attaché à une partie linéaire; il a au moins une extrémité.
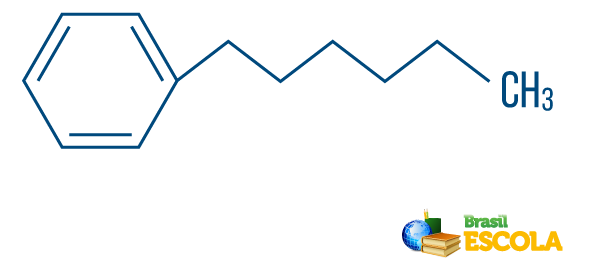
A lire aussi: Hydrocarbures aromatiques - exemples et propriétés
Nomenclature des hydrocarbures
Pour chaque type d'hydrocarbure, il existe une règle de dénomination établie par Iupac. La nomenclature de ces composés se fait comme suit :
1ère partie: emplacement et nom de la ou des succursales (le cas échéant);
2ème partie: le terme s'applique cycle si le composé est une chaîne fermée, mais s'il s'agit d'une chaîne aliphatique (ouverte), ce ne sera pas nécessaire ;
3ème partie: préfixe indiquant combien de carbones il y a dans la chaîne principale ;
4ème partie: emplacement et infixe indicatifs du type d'insaturation dans la molécule ;
5ème partie: suffixe « o » propre aux hydrocarbures.
Si la molécule a une structure ouverte, sans ramification, la nomenclature commencera dans la partie 3.
Le tableau suivant présente les informations requises (préfixe, infixe et suffixe) pour la nomenclature des hydrocarbures en général. O préfixe varie avec le nombre de carbones; O infixe, selon le nombre d'insaturations; C'est le suffixe“O" désigne des composés de type hydrocarbure.
Préfixe |
Infixe |
Suffixe |
||
1 carbone |
rencontré- |
Appels uniques uniquement |
-un- |
-O |
2 charbons |
et- |
|||
3 carbones |
soutenir- |
1 double liaison |
-fr- |
|
4 carbones |
mais- |
|||
5 carbones |
pent- |
2 doubles liaisons |
-dien- |
|
6 carbones |
hex- |
|||
7 carbones |
hept- |
1 triple liaison |
-dans- |
|
8 carbones |
oct- |
|||
9 carbones |
non- |
2 maillons triples |
-diin- |
|
10 carbones |
déc- |
La première étape pour découvrir la nomenclature d'un composé organique est identifier la chaîne principale de carbones, qui doit contenir les insaturations et autant de carbones séquentiels que possible. Après avoir identifié la chaîne principale, le les carbones doivent être dénombrés – en commençant le comptage par le côté le plus proche des branches et des insaturations (le cas échéant). LES localisation sera le numéro du carbone où se trouve la branche ou l'insaturation. Parfois, il n'y a qu'un seul emplacement possible pour un radical ou une double ou triple liaison, il n'est donc pas nécessaire d'exprimer l'emplacement du carbone de liaison dans la nomenclature.

LES nomenclature des succursales sera donné par le nombre de carbones dans chacun, plus la terminaison ligne ou alors ll. Lorsqu'il y a plus d'une branche, l'ordre alphabétique est utilisé.
Voir les exemples ci-dessous :
→ Exemple 1
CH3 – CH2 – CH3 → Propane
1ère partie: le préfixe «soutenir-” indique que la chaîne a trois carbones.
2ème partie: l'infixe "-un-” signale que la molécule ne fait que des connexions du type sigma ou simple.
3ème partie: le suffixe "-O» est caractéristique des hydrocarbures.
→ Exemple 2
CH2=CH-CH2-CH3 → But-1-ène
Dans les hydrocarbures à insaturation, il est nécessaire de numéroter et de localiser le carbone dans lequel se trouve le couple, et la numérotation doit être la plus petite possible. Pour cela, le nombre de carbones doit commencer par le côté le plus proche de la double liaison.
1ère partie: "mais-" indique qu'il y a quatre carbones dans la chaîne.
2ème partie: "1-fr" désigne une insaturation située entre le carbone 1 et 2.
3ème partie: "-O" est le suffixe caractéristique des hydrocarbures.
→ Exemple 3

1ère partie : "3-éthyle" signale qu'il y a une branche à deux carbones sur le carbone 2.
2ème partie: "-pent-" indique la présence de cinq carbones dans la chaîne principale.
3ème partie: "-un-" est l'infixe appliqué aux chaînes insaturées (pas de doubles ou triples liaisons).
4ème partie: "-O" est le suffixe caractéristique des hydrocarbures.
→ Exemple 4
Pour les chaînes avec plus d'une succursale, placez les radicaux dans la nomenclature par ordre alphabétique. S'il y a des branches et des insaturations dans la même molécule, le nombre de carbones dans la chaîne principale doit être fait de telle sorte que la somme des chiffres de localisation soit aussi petite que possible.
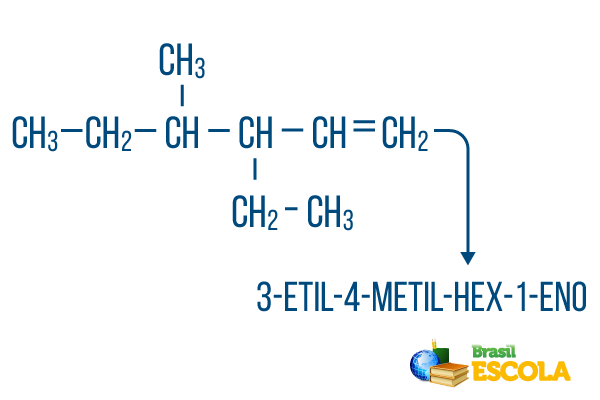
Le comptage du carbone de la chaîne principale a été effectué de gauche à droite, et la somme des chiffres d'insaturation et d'emplacement des branches est: 1+4+3 = 8. Si le nombre de carbones avait été de droite à gauche, la nomenclature composée serait 4-éthyl-3-méthyl-5-ène, dont la somme des emplacements serait: 4+3+5 = 12, ce qui est supérieur à l'autre hypothèse, il ne faut donc pas l'utiliser.
1ère partie: 3-éthyl-4-méthyle fait référence aux radicaux par ordre alphabétique et à leurs emplacements respectifs.
2ème partie: hex- signifie qu'il y a 6 carbones dans la chaîne principale.
3ème partie: 1-fr indique la présence d'une double liaison sur le carbone 1.
4ème partie: "-O" est le suffixe caractéristique des hydrocarbures.
→ Exemple 5
Pour les chaînes fermées, les règles de nommage sont valables, mais le mot cycle commence le nom du composé, indiquant qu'il s'agit d'un hydrocarbure fermé ou cyclique.
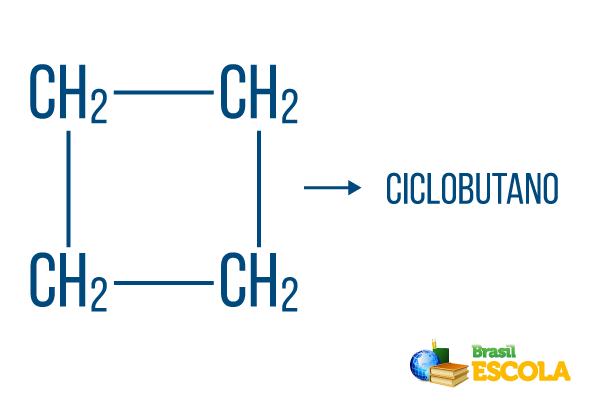
1ère partie: cycle- indique qu'il s'agit d'une chaîne fermée.
2ème partie: -mais- dénote l'existence de 4 carbones dans la chaîne
3ème partie: -Oest le suffixe caractéristique des hydrocarbures.
A lire aussi: Classification des chaînes carbonées
Types d'hydrocarbures
Les hydrocarbures peuvent être divisés en alcanes, alcènes, alcynes et alcadiènes - qui sont classés comme selon l'établissement de la chaîne (double(s) ou triple liaisons) - et des cyclanes, qui sont les chaînes fermé.
→ Alcanes : sont des hydrocarbures qui n'ont pas d'insaturation. La formule générale des alcanes est CnonH2n+2, et le nonomenclature il est composé de préfixe + un + O.
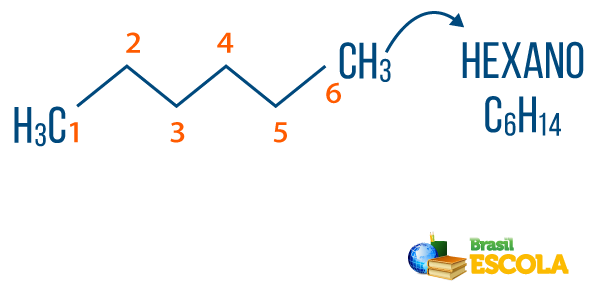
Toi alcanes peut être trouvé dans la nature, comme le gaz méthane (CH4), qui est rejetée par les animaux et produite dans les processus de décomposition, ainsi que dans les raffineries et les industries pétrochimiques. Des composés comme propane (Ç3H7), butane (Ç4H10), qui compose notre gaz de cuisine (GPL), et le octane (Ç8H18), présents dans le carburant automobile, sont des sous-produits de Pétrole.

→ alcènes ou alcènes: sont des chaînes carbonées qui ont une insaturation, une double liaison. Sa formule générale est CnonH2n, et le vôtre nonomenclature il est composé de Pcorriger + fr + o.

O gaz éthylène (Ç2H4), utilisé en agriculture pour accélérer la maturation des fruits, appartient à la fonction alcène. Le composé est également utilisé dans la production de matières premières polyéthylène, utilisé dans la fabrication d'ustensiles en plastique.
→ Alcynes ou acétylénique: hydrocarbures à triple liaison. Sa formule générale est CnonH2n - 2. LES nomenclature il est composé de préfixe + in + o.

O acétylène ou étine (C2H2) est un gaz de la fonction alcyne utilisé dans soudures et coupes de métal. Ce composé peut atteindre des températures allant jusqu'à 3 000 °C, ce qui permet d'effectuer des réparations sur les parties immergées d'un navire.

→ alcadiènes ou diènes: chaînes carbonées à deux insaturations, c'est-à-dire deux doubles liaisons entre les carbones. La formule générale de cette fonction est C.nonH2n - 2. Sachez que c'est la même formule que les alcynes, ce qui signifie que cela peut arriver isomérie entre les composés (même formule moléculaire pour différents composés).
La nomenclature d'un alcadiène est composée de Pcorriger + dien + o.
Exemple:

→ Hydrocarbures à chaîne fermée : les molécules s'organisent de façon cyclique, tendent à former un polygone et, comme dans les chaînes ouvertes, il peut y avoir des implantations et/ou des ramifications. Les cyclones, les cyclènes, les cyclines et les benzènes sont des hydrocarbures à chaîne fermée.
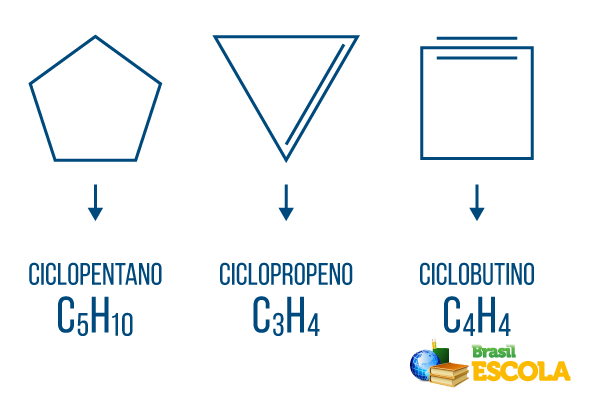
Cyclones ou cycloalcanes: chaînes cycliques constituées uniquement de liaisons simples. Sa formule générale est CnonH2n. Nomenclature: ciclo + préfixe + an + o.
Cycles ou cycloalcènes: chaînes d'hydrocarbures fermées avec un établissement. Sa formule générale est CnonH2n-2. Nomenclature: çiclo + préfixe + fr + O.
-
Cyclines ou cycloalcynes: hydrocarbures à chaîne fermée avec présence de deux doubles liaisons. Sa formule générale est CnonH2n-4. Nomenclature: çiclo + préfixe + in + o.
benzènes
Benzène est un type d'hydrocarbure à chaîne fermée avec six carbones où les liaisons varient entre simple et double. Ces composés sont toxique et hautement cancérigène, étant utilisé comme solvant organique dans les processus chimiques.
Pour que l'hydrocarbure soit considéré comme aromatique, il doit y avoir au moins un anneau de benzène, qui est très réactif, donc soumis à deux ou plusieurs remplaçants, que nous verrons ici comme des ramifications. Lorsqu'il y a deux radicaux de liaison, nous aurons des noms spécifiques pour chaque paire de positions.
Radiales sur 1,2 carbones du benzène → ortho
Radicaux aux carbones 1,3 du benzène → but
Radiales sur carbone1,4 du benzène → pour
L'annomenclature d'un composé aromatique se fait comme suit :
1ère partie: positionnement des ligands (ortho, but ou à).
2ème partie: nom du ou des radicaux attachés au benzène (méthyle, éthyle, propyle…). Le nom donné aux radicaux suit la règle des autres hydrocarbures.
- 3ème partie : -Bpoison, qui est le terme caractéristique des hydrocarbures aromatiques.
Exemples:
→ Ortho-diméthyl-benzène

1ère partie: Orto- indique que les radicaux sont positionnés sur les carbones 1 et 2.
2ème partie: -diméthyle- fait référence aux deux radicaux, tous deux avec un carbone.
3ème partie: -benzène est le terme caractéristique des hydrocarbures aromatiques.
→ Ortho-éthyl-méthyl-benzène
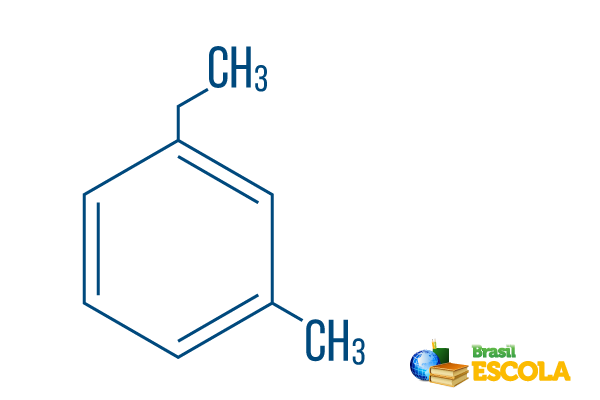
1ère partie: mOh- indique que les radicaux sont positionnés sur les carbones 1 et 3.
2ème partie: éthyl-méthyl- fait référence à la quantité de carbone dans chaque radical, étant éthyle le branche à deux carbones et méthyle ramification avec un carbone - placé dans la nomenclature par ordre alphabétique.
3ème partie: -benzène est le terme caractéristique des hydrocarbures aromatiques.
→ para-diéthyl-benzène
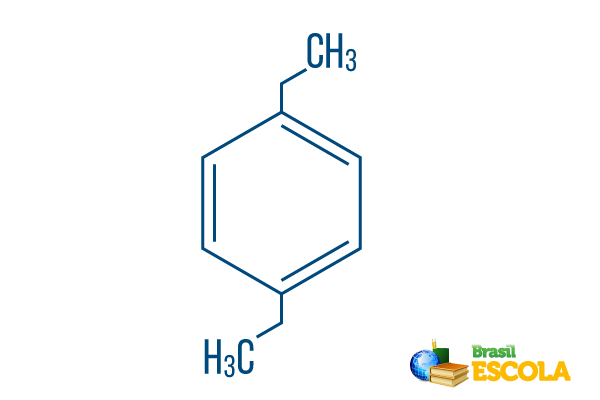
1ère partie: Pcharrue- indique que les radicaux sont sur les carbones 1 et 4 du benzène.
2ème partie: -diéthyle- fait référence à deux radicaux du type éthyle, c'est-à-dire deux branches avec deux carbones chacune.
3ème partie: -benzène est le terme caractéristique des hydrocarbures aromatiques.
A lire aussi :Découverte de la structure du benzène
exercices résolus
(Unesp) – L'octane est l'un des principaux constituants de l'essence, qui est un mélange d'hydrocarbures. La formule moléculaire de l'octane est :
a) C8H18
b) C8H16
c) C8H14
d) C12H24
e) C18H38
Réponse: lettre a). Analyse de la nomenclature composée octane, c'est un alcane, c'est-à-dire une molécule constituée uniquement de liaisons simples. Si la formule générale des alcanes est CnonH2n+2, en remplaçant « n » par huit, qui est la quantité de carbones dans la chaîne principale – et unique dans ce cas –, nous aurons que la formule moléculaire de l'octane est C8H18.
(UFSCar-SP) – Considérez les déclarations suivantes sur les hydrocarbures.
I) Les hydrocarbures sont des composés organiques constitués uniquement de carbone et d'hydrogène.
II) Seuls les hydrocarbures insaturés à chaîne droite sont appelés alcènes.
III) Les cycloalcanes sont des hydrocarbures aliphatiques saturés de formule générale CnH2n.
IV) Sont des hydrocarbures aromatiques: le bromobenzène, le p-nitrotoluène et le naphtalène.
Les affirmations suivantes sont correctes :
a) I et III, seulement.
b) I, III et IV uniquement.
c) II et III uniquement.
d) III et IV seulement.
e) I, II et IV uniquement.
Réponse: lettre a).
II – Les alcènes sont des composés à double liaison, c'est-à-dire insaturés, mais ils peuvent avoir des ramifications dans leur chaîne, n'étant pas exclusivement linéaires.
IV - Les composés du brométhobenzène et du p-nitrotoluène appartiennent à d'autres fonctions organiques.
par Laysa Bernardes
Professeur de chimie
La source: École du Brésil - https://brasilescola.uol.com.br/quimica/hidrocarbonetos.htm



