En 1911, le scientifique néo-zélandais Ernest Rutherford présenté à la communauté scientifique ses modèle atomique. Le modèle de Rutherford, également appelé modèle du système solaire, était le troisième dans l'histoire de l'Atomistique (les deux premiers étant le modèle de Dalton et le modèle de Thomson) et a été considéré comme le modèle qui a stimulé toute l'évolution des connaissances sur le constituant de la matière, l'atome.
La construction du modèle Rutherford part de l'étude des propriétés de rayon X et les émissions radioactives, aboutissant à l'utilisation de rayonnements sur un artefact inerte, c'est-à-dire qui ne réagit pas facilement.
Expérience réalisée par Rutherford
L'expérience menée par Rutherford avait l'appareil et l'organisation suivants :
Composant a - un échantillon de polonium (émetteur de rayonnement alpha) placé sur un bloc de plomb. Dans ce bloc, il y avait un petit trou par lequel passait le rayonnement ;
Composant b: lame d'or très fine positionnée devant la boîte de plomb ;
Composant c: Plaque métallique recouverte de matériau fluorescent (sulfure de zinc) positionnée derrière, à côté et un peu en avant de la plaque d'or.
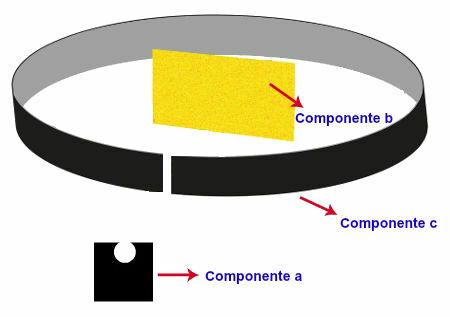
Représentation de l'expérience réalisée par Rutherford
Résultats de l'expérience de Rutherford
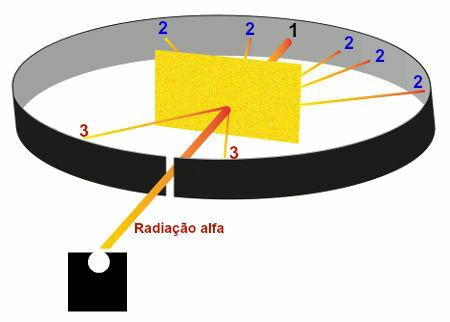
Représentation des résultats observés dans l'expérience de Rutherford
Région 1 : zone qui a reçu une grande partie du rayonnement alpha émis par le polonium, ce qui a montré que ces rayonnements traversaient la plaque d'or sans subir de déviations considérables ;
Région 2 : plusieurs zones, situées derrière la plaque d'or, qui ont reçu une petite quantité de rayonnement alpha mais n'étaient pas dans la direction de la trou de sortie des radiations dans la boîte de plomb, ce qui a montré que ces radiations ont subi une déviation or;
Région 3 : des zones situées devant la plaque d'or qui ont reçu une quantité extrêmement faible de rayonnement alpha, ce qui a montré qu'une partie du rayonnement alpha est entrée en collision avec la plaque et a été renvoyée.
Interprétations des résultats de l'expérience de Rutherford
Interprétation sur la région 1: Comme une grande partie du rayonnement alpha a traversé la plaque d'or sans aucune entrave, cela signifie que les atomes avait de grands espaces vides (électrosphère), c'est-à-dire des régions qui n'avaient rien capable d'influencer le rayonnement alpha;
Interprétation sur la région 2: La petite quantité de rayonnement alpha qui a subi une déviation est passée à proximité d'une région positive (noyau) de l'atome, probablement de petite taille, ce qui a favorisé la déviation.
Interprétation sur la région 3: Comme une quantité extrêmement faible de rayonnement alpha a été renvoyée, cela signifie qu'ils sont entrés en collision avec une région extrêmement petite de l'atome qui avait une caractéristique positive.
Caractéristiques du modèle atomique de Rutherford
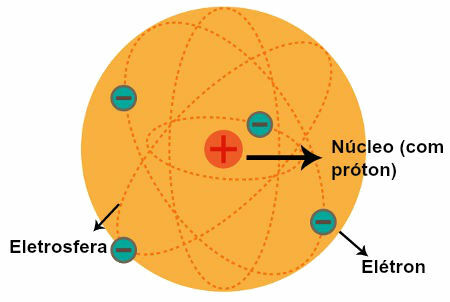
Représentation du modèle atomique de Rutherford
Après les observations faites par Rutherford, il a formulé son modèle atomique, qui avait les caractéristiques suivantes :
a) Nucleus (qui a été comparé au soleil dans le système solaire)
Une région centrale de l'atome qui a :
particules positives (les protons);
volume bas;
plus grande masse;
plus gros densité de l'atome.
b) Les électrosphères (qui ont été comparées aux orbites décrites par les planètes du système solaire)
Régions de l'atome qui ont :
d'énormes espaces vides entre eux;
particules de nature négative (les électrons).
Par moi Diogo Lopes Dias
La source: École du Brésil - https://brasilescola.uol.com.br/quimica/o-atomo-rutherford.htm
