O déplacer un équilibre chimique est la manière dont un système réactionnel sort d'une situation de équilibre chimique. Dans ce décalage, la vitesse à laquelle la réaction avant (flèche 1) a lieu est la même que la réaction inverse (flèche 2).

Modèle d'une équation en équilibre chimique
Ainsi, lors de la déplacer un équilibre chimique, la réaction inverse prévaut sur la réaction directe et tend à former les réactifs A, B, C, ou la réaction directe prévaut sur la réaction inverse et tend à former le produit D.
Ces événements ont été rapportés par le chimiste français Henri Louis Le Chatelier. Il a constaté que lorsqu'un système en équilibre est perturbé, il a tendance à aller à l'encontre de la perturbation générée et, pour cela, cherche à atteindre une nouvelle situation d'équilibre. Cette tendance du système est appelée principe du Chatelier.
Selon les études menées par Le Chatelier, les seuls facteurs susceptibles de favoriser déplacer un équilibre chimique elles sont:
Concentration des participants ;
Température;
Pression.
Influence de la concentration sur le changement d'équilibre
Le changement de concentration d'un participant à la réaction est un facteur qui peut favoriser la déplacer un équilibre chimique. En général, selon le principe de Le Chatelier, en ce qui concerne le changement de concentration d'un des participants, la balance se comporte comme suit :
Concentration accrue: la balance se déplace dans le sens opposé au participant ;
Diminution de la concentration: la balance se déplace dans le même sens que le participant.
Exemple de relation d'équilibre :

Modèle d'une équation en équilibre chimique
Donc si:
Nous augmentons la concentration des réactifs A, B ou C: le balancier sera décalé dans le sens inverse d'eux, c'est-à-dire qu'il sera décalé vers la droite (sens de formation de D) ;
On augmente la concentration du produit D: le solde se déplacera dans le sens inverse de celui des réactifs, c'est-à-dire qu'il se déplacera vers la gauche (sens de formation des réactifs A, B et C) ;
Nous diminuons la concentration des réactifs A, B ou C: l'équilibre se déplacera dans leur même sens, c'est-à-dire qu'il se déplacera vers la gauche (sens de formation des réactifs) ;
On diminue la concentration du produit D: la balance sera décalée dans le même sens qu'elle, c'est-à-dire qu'elle sera décalée vers la droite (sens de formation du produit).
Noter: Changer la concentration des participants solides ne modifie pas l'équilibre.
Influence de la température sur le déplacement d'équilibre
Le changement de température au cours d'une réaction chimique est un facteur qui peut favoriser la déplacer un équilibre chimique. Par rapport à ce changement de température, en général, selon le principe de Le Chatelier, la balance se comporte comme suit :
Ne vous arrêtez pas maintenant... Y'a plus après la pub ;)
En température montante: l'équilibre se déplace vers la réaction endothermique ;
En diminuant la température: l'équilibre se déplace vers la réaction exothermique.
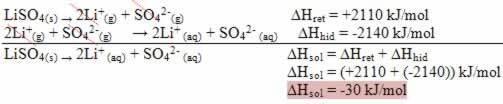
Pour réaliser l'analyse de l'influence de la température sur un équilibre, il est indispensable de connaître la nature des réactions directes et inverses, qui est déterminée par la variation de l'enthalpie de réaction. Donc si:
∆H positif: réaction directe endothermique et réaction inverse exothermique ;
∆H négatif: réaction directe exothermique et réaction inverse endothermique.
Par exemple, concernant le solde suivant :

Modèle d'une équation en équilibre chimique
Dans ce cas, en ayant un ∆H négatif, la réaction directe est exothermique et la réaction inverse est endothermique. Donc si:
Nous augmentons la température du système, l'équilibre se déplacera dans le sens inverse (de la réaction endothermique), c'est-à-dire qu'il se déplacera vers la gauche (sens de la formation des réactifs) ;
Nous abaissons la température du système, l'équilibre se déplacera dans le sens direct (de la réaction exothermique), c'est-à-dire qu'il se déplacera vers la droite (sens de la formation du produit D).
Influence de la pression sur le déplacement du balancier
Lors d'une réaction chimique, le changement de pression dans l'environnement est un facteur qui peut favoriser la déplacer un équilibre chimique. En général, selon le principe de Le Chatelier, la balance se comporte comme suit avec (a) :
augmentation de la pression: la balance se déplace vers le plus petit volume ;
Diminution de la pression: l'équilibre se déplace vers un plus grand volume.
Pour analyser l'influence de la pression sur un équilibre, il est indispensable de connaître le volume établi dans le réactifs et produits, qui peuvent être déterminés par les coefficients qui équilibrent l'équation, comme dans l'exemple poursuivre:

Modèle d'une équation en équilibre chimique
Ainsi, les réactifs ont un volume de 4L, qui est obtenu par la somme des coefficients 1, 2 et 2, et le produit, qui est unique, a un volume de 3L (donné par le coefficient 3).
Ainsi, par rapport au solde ci-dessus, si :
Nous augmentons la pression du système, la balance sera décalée dans le sens direct (à partir du plus petit volume, 3L), c'est-à-dire qu'elle sera décalée vers la droite (sens de formation du produit D).
Nous diminuons la pression du système, l'équilibre sera décalé dans le sens opposé (à partir du plus grand volume, 4 L), c'est-à-dire qu'il sera décalé vers la gauche (le sens de la formation des réactifs).
Noter: L'augmentation ou la diminution de la pression dans un système à l'équilibre ne peut favoriser le déplacement que dans des situations où le volume des réactifs est différent du volume des produits.
Par moi Diogo Lopes Dias
Souhaitez-vous référencer ce texte dans un travail scolaire ou académique? Voir:
JOURS, Diogo Lopes. "Déplacement de l'équilibre chimique"; École du Brésil. Disponible en: https://brasilescola.uol.com.br/quimica/fatores-que-alteram-equilibrio-quimico.htm. Consulté le 28 juin 2021.
Chimie

Testez vos connaissances et apprenez-en plus avec cette liste d'exercices résolus sur les équilibres chimiques. Grâce à ce matériel, vous pourrez mieux comprendre comment travailler les constantes d'équilibre (Kp, Kc et Ki), le décalage d'équilibre, le pH et le pOH, ainsi que l'équilibre dans les solutions dites tampons.