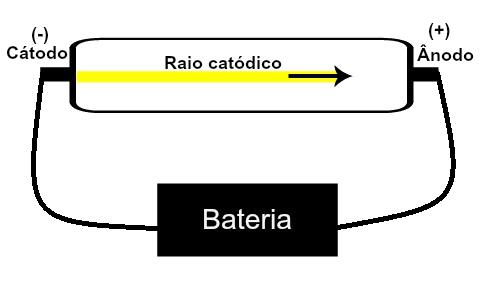
Les carbonates sont des composés inorganiques formés par la liaison ionique d'un métal ou d'un semi-métal avec l'anion carbonate, CO32-.
Le carbone est tétravalent, c'est-à-dire qu'il a quatre électrons dans la couche de valence, et il peut faire quatre liaisons covalentes pour être stable, tandis que l'oxygène est bivalent, ayant six électrons dans la couche de valence et pouvant faire deux liaisons pour être stable, avec huit électrons. Ainsi, il y a une forte tendance pour un carbone à se lier à deux atomes d'oxygène, qui sont tous stables (O C ═ O → CO2).
Mais d'autres oxygènes peuvent se combiner avec du carbone, puisque le rapport des rayons ioniques conduit à un nombre de coordination égal à 3, formant une structure triangulaire dans lequel le carbone est au centre, faisant une double liaison avec l'un des atomes d'oxygène et deux liaisons simples avec les deux autres oxygènes. Le résultat est deux électrons en excès, puisque ces deux oxygènes ne sont pas stables, nécessitant de recevoir un électron chacun :

L'anion carbonate est formé par des liaisons covalentes, mais ses composés, qui sont des sels inorganiques et minéraux connus sous le nom de carbonates, sont ioniques, car ce radical reçoit deux électrons d'un métal ou d'un semi-métal, formant un liaison ionique.
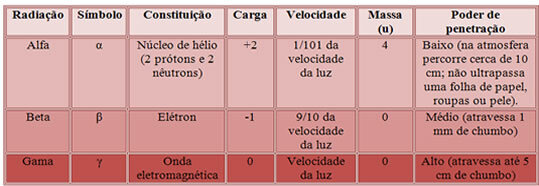
Ces composés sont insolubles dans l'eau, à l'exception du carbonate d'ammonium ((NH4)2CO3) et les carbonates formés avec des métaux alcalins (éléments de la famille 1: Li, Na, K, Rb, Cs et Fr). Presque tous sont des solides blancs, comme le montre l'image ci-dessous :

Les deux exemples quotidiens les plus courants et les plus importants de carbonates sont le carbonate de sodium (Na2CO3) et le carbonate de calcium (CaCO3). Dans le premier cas, le sodium appartient à la famille 1, ayant un électron dans la couche de valence et tendant à perdre cet électron pour se stabiliser. Comme l'anion carbonate doit recevoir deux électrons, il se lie à deux atomes de sodium :
Ne vous arrêtez pas maintenant... Y'a plus après la pub ;)

Le carbonate de sodium est plus connu sous le nom de soude ou soude, étant utilisé dans la fabrication de savons, de teintures, de médicaments, de papiers et dans le traitement de l'eau de piscine. Mais sa principale application est avec le carbonate de calcium et le sable dans la fabrication du verre.
Le calcium est de la famille 2, ayant tendance à perdre deux électrons. Ainsi, un atome de calcium se lie à un radical carbonate :

Le carbonate de calcium est présent dans le calcaire et le marbre. À stalactites et stalagmites qui existent dans les grottes sont constitués de ce carbonate; coquillages, récifs coralliens et coquilles d'œufs aussi. Lorsque nous blanchissons les murs, les troncs d'arbres et d'autres endroits, nous utilisons de l'hydroxyde de calcium (Ca(OH)2), qui réagit avec le temps avec le dioxyde de carbone atmosphérique pour former du carbonate de calcium.

Les carbonates sont très répandus à la surface de la terre, comme dans le cas des minéraux. Son réticulum cristallin peut se réorganiser dans l'espace de deux manières: l'orthorhombique (comme c'est le cas avec l'aragonite minérale montrée ci-dessus avec la formule du carbonate de calcium) et le rhomboédrique ou trigonale, comme c'est le cas de la calcite (un autre minéral constitué de carbonate de calcium).
Les carbonates réagissent en présence d'acides, libérant du CO2, qui se voit facilement à travers une effervescence.
Par Jennifer Fogaça
Diplômé en Chimie
Souhaitez-vous référencer ce texte dans un travail scolaire ou académique? Voir:
FOGAÇA, Jennifer Rocha Vargas. « carbonates »; École du Brésil. Disponible en: https://brasilescola.uol.com.br/quimica/carbonatos.htm. Consulté le 28 juin 2021.
Chimie

Carbonate de sodium, méthode Leblanc, méthode Ernest Solvay, carbonate de sodium, soude, fabrication courante du verre, traitement de l'eau de piscine, contrôle du pH de l'eau, traitement textile, additif alimentaire.
Chimie

Sels courants, carbonate de calcium, chlorure de sodium, fluorure de sodium, nitrate de potassium, nitrate de sodium sodium, carbonate de sodium, bicarbonate de sodium, bicarbonate de sodium, sulfite de sodium, salpêtre, un soda.