Les atomes sont des particules infiniment petites qui composent toute la matière de l'univers. Au fil du temps, l'idée de ce à quoi ressemblerait la structure atomique a changé en fonction des nouvelles découvertes faites par les scientifiques. Vous pouvez en savoir plus à ce sujet dans le texteÉvolution du modèle atomique.
Un modèle est une représentation de la réalité (pas la réalité elle-même), donc les modèles atomiques sont des représentations de principaux composants de l'atome et de sa structure et expliquer certains comportements physiques et chimiques de la matière. Ceci est fait parce qu'il n'est pas encore possible pour un être humain de voir un atome isolé même avec des ultramicroscopes.
Pour avoir une idée de la petite taille de l'atome, sachez que le La plus petite particule visible au microscope ordinaire contient plus de dix milliards d'atomes ! L'atome est si petit que, si on en mettait un million côte à côte, on n'atteindrait pas le épaisseur d'un cheveu.
Carte mentale: Atome
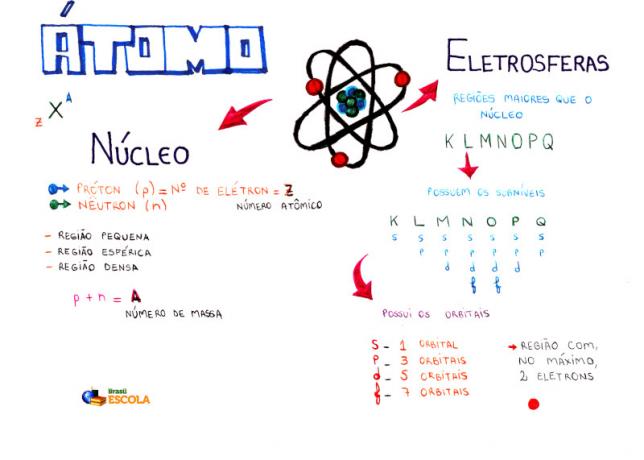
* Pour télécharger la carte mentale en PDF, Cliquez ici!
Parmi les modèles atomiques, le plus utilisé actuellement au lycée pour comprendre la structure de l'atome et ses propriétés est le modèle de Rutherford-Bohr. Selon ce modèle, la structure de l'atome se compose de deux parties principales: la cœur et le électrosphère.

Deux parties principales de la structure d'un atome - électrosphère et noyau
* Cœur: Constituant la partie centrale de l'atome, il est compact, massif et très dense, en plus d'être formé de particules de plus grande masse, qui sont des protons et des neutrons.

Illustration des protons et des neutrons qui composent le noyau atomique
- Protons : ce sont des particules avec une charge électrique positive (charge relative = +1; charge en coulomb (C) = +1,602. 10-19) et sa masse relative est égale à 1.
Le fait que les protons forment le noyau et lui confèrent une charge globale positive a été découvert par Eugène Goldstein, en 1886, par une modification de l'ampoule de Crookes et quelques expériences. Il a vu que, sous de très hautes tensions, des émissions apparaissaient (rayons anodiques - restes d'atomes de gaz qui se trouvaient à l'intérieur de l'ampoule et dont les électrons ont été arrachés par la décharge électrique). En plaçant un champ électrique ou magnétique à l'extérieur de l'ampoule, ces rayons étaient déviés vers le pôle négatif. Cela signifiait qu'il y avait des particules subatomiques positives, appelées protons.
Plus tard, Ernest Rutherford (1871-1937) a réalisé l'expérience décrite dans le texte Atome de Rutherford, ce qui l'a amené à découvrir l'emplacement du proton: dans le noyau.
- Neutrons : ce sont des particules de masse égale à celle des protons (1), mais comme leur nom l'indique, elles sont neutres, c'est-à-dire qu'elles n'ont pas de charge électrique.
Les neutrons ont été découverts en 1932 par James Chadwick (1891-1974), qui s'est rendu compte que le noyau de béryllium radioactif émettait des particules neutres d'une masse à peu près égale à la masse des protons (en fait, elle est légèrement plus grande).
Ne vous arrêtez pas maintenant... Y'a plus après la pub ;)
Le diamètre du noyau dépend de la quantité de protons et de neutrons que possède l'atome, mais, en moyenne, il est d'environ 10-14 mois et 10-15 m.
Le noyau atomique concentre pratiquement toute la masse de l'atome, soit une très petite partie: le proton et le neutron sont environ 100 000 fois plus petits que l'atome tout entier ! A titre de comparaison, imaginons que nous agrandissions le noyau de l'atome de l'élément hydrogène (qui n'a que un proton) à la taille d'une balle de tennis, l'électron le plus proche serait à environ trois kilomètres de distance! Même si un atome était agrandi à la hauteur d'un immeuble de 14 étages, son noyau aurait la taille d'un simple grain de sel au septième étage. C'est vraiment quelque chose d'incroyable, vous ne trouvez pas ?!
* Electrosphère : Est région où les électrons tournent autour du noyau. Bien qu'il s'agisse d'une région de volume beaucoup plus grand que le noyau, elle est pratiquement vide, car chaque électron est 1836 fois plus petit qu'un proton (ou qu'un neutron). C'est pourquoi la masse de l'atome est pratiquement entièrement dans le noyau. Les électrons sont des particules avec une charge électrique négative (-1).
Les électrons ont été découverts en 1897 par Joseph John Thomson (1856-1940), le créateur de Modèle atomique de Thomson. L'expérience de Thomson peut être vue en détail dans le texte L'expérience de Thomson avec les décharges électriques, mais en bref, il a utilisé l'ampoule de Crookes susmentionnée et s'est rendu compte que les rayons cathodiques étaient toujours attirés par le pôle positif, ce qui prouvait que l'atome avait des particules négatives, appelées électrons.
Les électrons tournent autour du noyau des milliards de fois par millionième de seconde, façonnant l'atome et le faisant se comporter comme s'il était solide.
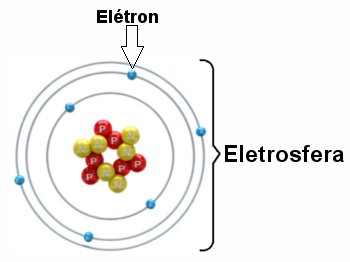
Illustration d'une électrosphère avec trois couches électroniques et des électrons tournant autour du noyau.
Brièvement, on peut faire un tableau pour différencier les trois principales particules subatomiques qui font partie de la structure de l'atome :

Masse et charge électrique des trois principales particules subatomiques - protons, neutrons et électrons
Les atomes de tous les éléments chimiques sont composés de ces trois particules subatomiques. Ce qui diffère d'un élément chimique à un autre, c'est la quantité dans laquelle ces particules apparaissent, en particulier la quantité de protons dans le noyau, que l'on appelle le numéro atomique. Continuez à l'étudier à travers le texte. Élément chimique.
* Mind Map par Me. Diogo Lopes
Par Jennifer Fogaça
Diplômé en Chimie
Chimie
Classification de la matière, de l'eau, du gaz cyanhydrique, du dioxyde de carbone, de l'ammoniac, de l'hydrogène, de l'hélium, des substances substances simples, composées, mélanges, phases d'un mélange, mélange homogène, mélange hétérogène.