Avant d'introduire le concept de masse molaire et nombre de mole, examinons quelques définitions importantes dans ce contexte :
→ Terme molaire
Molaire vient du mot molécule, mais qu'est-ce qu'une molécule exactement? C'est l'ensemble des atomes qui sont liés par des liaisons chimiques.
→ Masse moléculaire (MM)
Il est possible de calculer la masse d'une molécule par la somme des masses atomiques de chaque atome qui compose la molécule respective. Le résultat est appelé masse moléculaire (MM).
Quelle serait la masse moléculaire du sulfure d'hydrogène (H2S) par exemple ?
Vous devez d'abord savoir quelle est la masse atomique de chaque atome, qui est donné par le tableau périodique des éléments.
Masse atomique d'hydrogène (H) = 1 m.u. (unité par masse atomique)
Masse atomique de soufre (S) = 32,1 a.u.u.
La masse moléculaire est la somme des masses atomiques des atomes.
Remarque: l'hydrogène de la molécule H2S a un coefficient de 2, vous devez donc multiplier sa masse par 2. Calculateur:
Masse moléculaire de H2S = 1 • 2 + 32,1 = 34,1 u
(H) + (S) = (H)2S)
Masse molaire et nombre de moles
Ne vous arrêtez pas maintenant... Y'a plus après la pub ;)
La masse molaire, ainsi que le nombre de moles, est liée à la Constante d'Avogadro (6,02 x 1023) par le concept suivant :
''Le nombre d'entités élémentaires contenues dans 1 mole correspond à la constante d'Avogadro, dont la valeur est 6,02 x 1023 mole-1.''
Par conséquent, la masse molaire est la masse de 6,02 x 1023 entités chimiques et s'exprime en g/mol.
Carte mentale - Mol
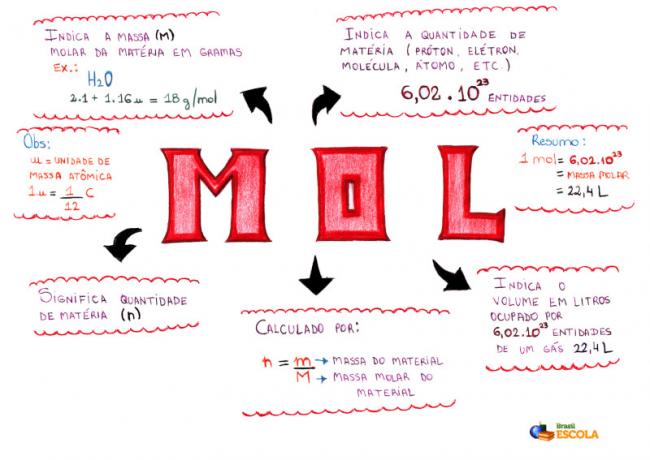
* Pour télécharger la carte mentale, Cliquez ici!
Exemple: H2s
Masse moléculaire = 34,1 u
Masse molaire (M) = 34,1 g/mol
Cela signifie qu'à 34,1 g/mol de sulfure d'hydrogène, nous avons 6,02 x 1023 molécules ou 1 mole de molécules de sulfure d'hydrogène.
Conclusion
La masse moléculaire et la masse molaire ont les mêmes valeurs, ce qui diffère est l'unité de mesure. La masse molaire est liée au nombre de moles qui est donné par la constante d'Avogadro.
* Mind Map par Me. Diogo Lopes
Par Líria Alves
Diplômé en Chimie
Souhaitez-vous référencer ce texte dans un travail scolaire ou académique? Voir:
SOUZA, Líria Alves de. "Masse molaire et nombre de moles"; École du Brésil. Disponible en: https://brasilescola.uol.com.br/quimica/massa-molar-numero-mol.htm. Consulté le 27 juin 2021.