Siirtymisreaktiot, kutsutaan myös korvausreaktiottai edelleen yksinkertainen vaihto, ovat niitä, joita tapahtuu, kun yksinkertainen aine (muodostuu yhdestä elementistä) reagoi yhdisteaineen kanssa, "syrjäyttämällä" jälkimmäisen uudeksi yksinkertaiseksi aineeksi.
Yleensä voimme määritellä sen seuraavasti:
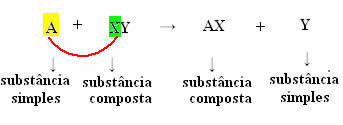
Mutta jotta tämä tapahtuisi, yksinkertainen aine, tapauksessa, jota symboloi A, täytyy olla reaktiivisempi kuin yhdisteestä syrjäytyvä alkuaine, muuttamalla itsensä uudeksi yksinkertaiseksi aineeksi (Y).
Katsotaanpa esimerkkiä, missä tämä reaktio tapahtuu:
Huomioi alla oleva koe, jossa sinkkilevy (Zn) asetetaan kuparisulfaatin vesiliuokseen (CuSO4). Ajan myötä todetaan, että kuparisulfaattiliuos muuttuu sinisestä väristä vähemmän voimakkaaksi siniseksi, koska se muuttui väriksi ja sinkkilevyssä oli kuparikerrostumaa.

Voimme edustaa tätä reaktiota käyttämällä seuraavaa kemiallista yhtälöä:

Huomaa, että sinkki on syrjäyttänyt kuparin, mikä tarkoittaa, että sinkki on reaktiivisin.
Koska molemmat ovat metalleja, voimme tarkistaa, tapahtuuko yksinkertainen vaihtoreaktio vai ei
metallireaktiivisuusjono nähtävissä alapuolella:Älä lopeta nyt... Mainonnan jälkeen on enemmän;)

Huomaa, että kupari on todellakin vähemmän reaktiivinen kuin sinkki, joten jos päätämme tehdä päinvastoin kuin edellinen kokeilu ja laittaa kuparilevy sinkkisulfaattiliuokseen, reaktio ei tapahtuisi, koska kupari ei pystyisi syrjäyttämään sinkki.
Siirtymisreaktiot ovat eräänlainen redoksireaktio, koska elektronit siirtyvät yksinkertaisesta aineesta komposiittiin. Edellä selitetyssä prosessissa sinkki oli alun perin neutraalissa muodossaan, joka on metallista, ja tuli osa yhdistettä, jossa sillä on yli 2 varausta, toisin sanoen jokainen sinkkiatomi on menettänyt kaksi elektronit. Kuparin kanssa tapahtuu päinvastoin, se vastaanottaa kaksi elektronia siirtymään metalliseen kiinteään tilaan.
Yksinkertaisen vaihtoreaktion tapauksessa ei-metallien kanssa se otetaan huomioon: reaktio tapahtuu vain, jos reaktiivisin ei-metalli on yksinkertainen aine, joka voi syrjäyttää toisen vähemmän reaktiivisen ei-metallin. Ametaalien reaktiivisuus on esitetty alla:

Kirjailija: Jennifer Fogaça
Valmistunut kemian alalta
Haluatko viitata tähän tekstiin koulussa tai akateemisessa työssä? Katso:
FOGAÇA, Jennifer Rocha Vargas. "Syrjäyttäminen, korvaaminen tai yksinkertaiset vaihtoreaktiot"; Brasilian koulu. Saatavilla: https://brasilescola.uol.com.br/quimica/reacoes-deslocamento-substituicao-ou-simples-troca.htm. Pääsy 28. kesäkuuta 2021.