Hybridisaatioteoria nousi esiin täydentäen Oktettiteoria, joka onnistuu selittämään suuremman määrän molekyylien, mukaan lukien boorin (B) muodostamat molekyylit, rakenteen.
Tässä elementissä on viisi maadoituselektronia seuraavalla elektronisella kokoonpanolla:
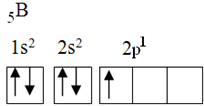
Oktetiteorian mukaan boori pystyi muodostamaan vain yhden kovalenttisen sidoksen, koska sillä on vain yksi epätäydellinen atomirata. Kokeellisesti on kuitenkin huomattava, että tämä alkuaine muodostaa yhdisteitä, joissa se suorittaa useamman kuin yhden sidoksen.
Esimerkki on booritrifluoridi (BF3). Kuten alla on esitetty, boori muodostaa kolme kovalenttista sidosta fluorin kanssa jakamalla kolme paria - elektronit ja viimeisessä kuoressa (valenssikerros) on kuusi elektronia, toisin sanoen poikkeus oktetti.
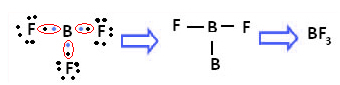
Tämä selittyy boorin kanssa tapahtuvalla hybridisaatioilmiöllä. On käynyt ilmi, että alatason 2 elektronit absorboivat energiaa ja menevät viritettyyn tilaan, jossa se hyppää alatason 2p tyhjälle kiertoradalle. Tällä tavalla muodostuu kolme epätäydellistä orbitaalia, jotka voivat nyt muodostaa kolme kovalenttista sidosta:
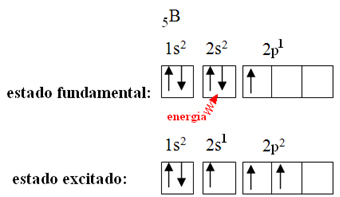
Booritrifluoridissa muodostuneet sidokset ovat kuitenkin samat, mutta jos katsomme edellä, on olemassa kaksi sidosta erilaiset, koska toinen niistä valmistettaisiin s-kiertoradalla ja kaksi muuta tyypin kiertoradalla. tyyppi s. Täällä tapahtuu hybridisaatio, toisin sanoen epätäydelliset kiertoradat sulautuvat, jolloin syntyy kolme hybridi kiertoradat tai hybridisoitu, jotka ovat identtisiä ja erilaisia kuin alkuperäiset:
Älä lopeta nyt... Mainonnan jälkeen on enemmän;)
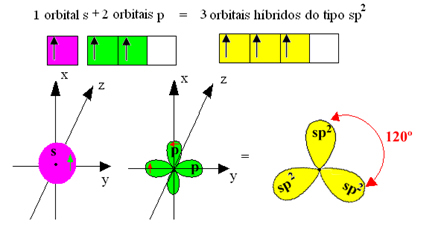
Koska nämä hybridiorbitaalit koostuvat yhdestä orbitaalista ja kahdesta orbitaalista, tätä hybridisaatiota kutsutaan sp²-hybridisaatio.
Booriin sitoutuvassa fluorissa on yhdeksän elektronia. Sen sähköinen jakelu ja kiertoradat on esitetty alla:
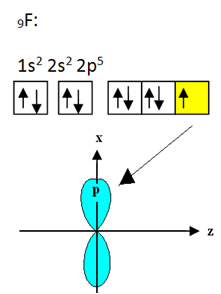
Huomaa, että jokainen fluoriatomi voi muodostaa vain yhden kovalenttisen sidoksen ja että tämän sidoksen muodostava kiertorata on tyypin p. Joten seuraa alla, kuinka orbitaalit muodostuvat, kun muodostetaan BF: n muodostavat yhteydet3 ja katso kuinka linkit ovat identtisiä, kuten σp-sp2:
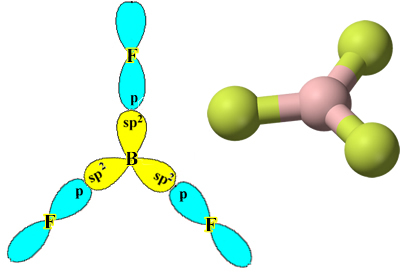
Tämä tapahtuu myös muiden elementtien kanssa, katso esimerkiksi teksti "Beryllium-hybridisaatio”.
Kirjailija: Jennifer Fogaça
Valmistunut kemian alalta
Haluatko viitata tähän tekstiin koulussa tai akateemisessa työssä? Katso:
FOGAÇA, Jennifer Rocha Vargas. "Boorin hybridisaatio"; Brasilian koulu. Saatavilla: https://brasilescola.uol.com.br/quimica/hibridizacao-boro.htm. Pääsy 28. kesäkuuta 2021.