Yksi keino kemiallisten alkuaineiden organisoinnista on perheiden kautta, jotka vastaavat jaksollisen järjestelmän vertikaalisia sekvenssejä.
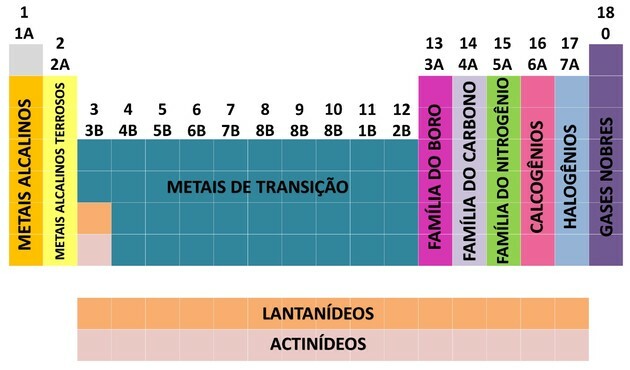
Klo 18 saraketta taulukon ryhmittely elementit kemiallisten ominaisuuksien samankaltaisuuden mukaan.
Kemiallisten alkuaineiden järjestäminen perheiksi oli käytännöllinen tapa jäsentää löydetyt tiedot ja esittää ne yksinkertaisella tavalla.
Kemiallisen alkuaineen paikantamisen helpottamiseksi perheet nimettiin numeroilla 1-18 seuraavasti:
Usean tutkijan panoksen ja erilaisten tietojen järjestämisyritysten kautta jaksollinen taulukko kehittyi ja loi järjestyksen elementtien järjestämiseksi.
Perheiden nimikkeistö
- Taulukon perheet jaettiin A (edustava) ja B (siirtyminen), jotka tunnistettiin kirjaimilla ja numeroilla.
- Sinä edustavia elementtejä Perheet 0, 1A, 2A, 3A, 4A, 5A, 6A ja 7A vastaavat.
- Sinä siirtymäelementit Perheet 1B, 2B, 3B, 4B, 5B, 6B, 7B ja 8B vastaavat.
- Kansainvälisen puhtaan ja sovelletun kemian liiton (IUPAC) määrittelemällä perheet tunnistettiin ryhmät 1-18.
Jaksolliset taulukot ja sähköinen jakelu
Saman perheen elementtien välillä on yhtäläisyyksiä, koska atomin valenssielektronien määrä perustilassa on sama tietyn ryhmän jäsenille.
Esimerkiksi:
| Ryhmä 1 | Eletroninen jakautuminen |
|---|---|
| 3lukea | 2-1 |
| 11Klo | 2-8-1 |
| 19K | 2-8-8-1 |
| 37Rb | 2-8-18-8-1 |
| 55Cs | 2-8-18-18-8-1 |
| 87Fr | 2-8-18-32-18-8-1 |
Ryhmän 1 atomien elektronit ovat jakautuneet useammalle kuin yhdelle energiatasolle, mutta kaikilla on valenssielektroni.
Sen avulla havaitsemme, että elektroninen jakauma atomin perustilassa, löydämme sen sijainnin jaksollisessa taulukossa.
edustavia elementtejä
Edustavien elementtien kemiallinen käyttäytyminen on suhteellisen vähemmän monimutkaista kuin siirtymäelementeillä, ja ne muodostavat suurimman osan aineista ympärillämme.
Joillekin edustavista elementtiperheistä annetaan erityisnimet, kuten alla on esitetty:
Ryhmä |
Perhe | tietty nimi | Nimen alkuperä | Elementit | elektroninen kokoonpano |
|---|---|---|---|---|---|
| 1 | 1A | alkalimetallit | latinasta alkali, mikä tarkoittaa "kasvien harmaata". | Li, Na, K, Rb, Cs ja Fr | meille1 |
| 2 | 2A | maa-alkalimetallit | Termi "maallinen" viittaa "olemassa olevaan maan päällä". | Ole, Mg, Ca, Sr, Ba ja Ra | meille2 |
| 13 | 3A | booriperhe | Perheen ensimmäisen osan nimi. | B, Al, Ga, In, Tl ja Nh. | meille2np1 |
| 14 | 4A | hiiliperhe | Perheen ensimmäisen osan nimi. | C, Si, Ge, Sn, Pb ja Fl. | meille2np2 |
| 15 | 5A | Typpiperhe | Perheen ensimmäisen osan nimi. | N, P, As, Sb, Bi ja Mc. | meille2np3 |
| 16 | 6A | Kalkogeenit | kreikkalaiselta khalks, koska ne ovat kuparimalmeissa esiintyviä alkuaineita. | O, S, Se, Te, Po ja Lv. | meille2np4 |
| 17 | 7A | Halogeenit | Kreikan ilmaus, joka tarkoittaa suolanmuodostajia. | F, Cl, Br, I, At ja Ts. | meille2np5 |
| 18 | 0 | Jalokaasut | Sen ei katsottu reagoivan muiden aineiden kanssa. | Hän, Ne, Ar, Kr, Xe, Re ja Og. | 1s2 (Hän) tai meitä2np6 |
Taulukon läpi voimme nähdä, että:
- Edellä esitetyt elementit luokitellaan edustaviksi, koska niillä on eniten energistä elektronia s- tai p-alatasolla.
- Elektronit jakautuvat energiatasoille ja n edustaa atomin uloiminta tasoa perustilassa.
- Edustavat elementit kuuluvat IUPAC: n suosituksen mukaan ryhmiin tai perheisiin 1,2,13,14,15,16,17 ja 18.
O vety se luokitellaan erillään muista elementeistä. Jopa 1s: n elektronisella kokoonpanolla1, hän ei kuulu ryhmään 1 yksittäisen käyttäytymisen esittämiseksi.
siirtymäelementit
Siirtymäelementit vastaavat ryhmiä 3-12. He saavat tämän nimen, koska niillä on väliominaisuudet ryhmien 1 ja 2 ja edustavien ei-metallisten elementtien välillä.
Sinä siirtymämetallit IUPAC määrittelee:
Siirtymäelementillä on epätäydellinen d-alataso tai se voi muodostaa kationeja epätäydellisen d-alatason kanssa.
Kun perustilan atomin energisin elektroni on epätäydellisessä d-alatasossa, sitä luonnehditaan ulkoiseksi siirtymäksi.
Lantanidit ja aktinidit ovat sisäisiä siirtymäelementtejä, koska niillä on ainakin yksi epätäydellinen f-alataso.
Kun elementeillä on elektroneja, jotka täyttävät d- tai f-orbitaalit, niillä on samanlaiset ominaisuudet ja ne voidaan luokitella d- tai f-orbitaalielementteihin. ulompi tai sisempi siirtymä.
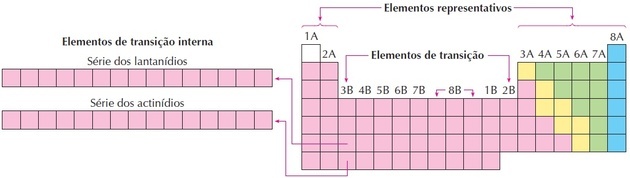
Kuten kuvasta voidaan nähdä, perhe 8B vastaa 3 saraketta, ne ovat ryhmiä 8, 9 ja 10, jotka ryhmiteltiin näin, koska niillä on samanlaiset ominaisuudet.
Perheiden pääominaisuudet
Alla olevassa taulukossa on esitetty jaksollisen taulukon ryhmien pääominaisuudet:
| Ryhmä | ominaisuudet | yhdisteaineet yleisempi |
poikkeamia |
|---|---|---|---|
| 1 | Kiinteä ja kiiltävä ympäristöolosuhteissa. Erittäin reaktiiviset, pehmeät ja hyvät sähkönjohtimet. | Suolat, hydroksidit ja oksidit |
Reagoi halogeenien kanssa ja muodosta suoloja. |
| 2 | Vähemmän reaktiivinen ja kovempi kuin ryhmä 1. Hopeanväriset kiinteät aineet, joilla on hyvä johtavuus. | Suolat, hydroksidit ja oksidit |
Muodostavat suoloja ja oksideja. |
| 3 - 12 | Ne muodostavat komplekseja. Ne ovat metallisia kiintoaineita, kovia ja hauraita, lukuun ottamatta elohopeaa, joka on neste. | Suolat, oksidit ja kompleksit. Esim.: AgNO3, TiO ja [Cr (OH)3(H2O)3] |
Mineraaleissa oksidien muodossa. |
| 13 | Kiinteät aineet ympäristöolosuhteissa, hopea booria lukuun ottamatta. | Oksidit Esimerkki: B2O3 |
Mineraaleissa oksidien muodossa. |
| 14 | Kiinteä ympäristöolosuhteissa. | C: n ja Si: n atomit voivat järjestyä ketjuihin ja tuottaa valtavan määrän erilaisia aineita. | Elävissä organismeissa ja silikaattien tai oksidien muodossa. |
| 15 | Kiinteät aineet, lukuun ottamatta typpeä, joka on kaasumaista ympäristön olosuhteissa. | Oksidit ja hapot Esimerkki: EI2 ja H3PÖLY4 |
Ilmakehä, elävät organismit ja mineraalit. |
| 16 | Kiinteät aineet, paitsi happi, joka on kaasumaista ympäristön olosuhteissa. | Sulfidit ja oksidit Esim.: ZnS ja SiO2 |
Ilmakehä, elävät organismit ja mineraalit. |
| 17 | Ne muodostavat piimaamolekyylejä ja ovat erittäin reaktiivisia. Ne ovat huonoja sähkön ja lämmön johtimia. Ne ovat aggressiivisia eläville olennoille ja ympäristölle. | Hapot ja suolat. Esimerkki: HCI ja KBr |
Ovat aineissa orgaaninen ja mineraali. |
| 18 | Ne ovat erittäin stabiileja ja niitä esiintyy kaasuina. | Ne tuskin muodostavat yhdisteaineita. | Kaasuja ilmakehässä. |
Kemialliset ja fysikaaliset ominaisuudet erottavat perheen toisesta. Kuten olemme nähneet, kemialliset ominaisuudet liittyvät elektronit valenssiaja niiden kautta atomi on vuorovaikutuksessa toisen kanssa vastuussa kemiallisesta käyttäytymisestä ja kemialliset sidokset muodostettu.
Saman ryhmän elementtien fysikaaliset ominaisuudet voivat vaihdella atomimäärän ja massan mukaan.
Harjoitukset
Nyt kun tiedät vähän enemmän jaksollisista taulukoista, testaa tietosi ja katso, mitä olet oppinut.
1) Tarkastellaan seuraavaa jaksollisen taulukon otetta.
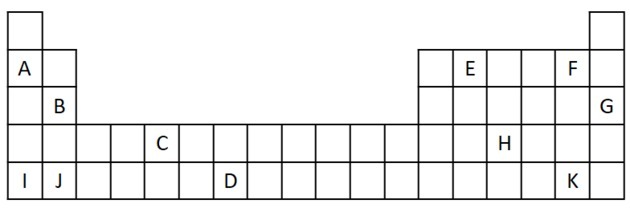
a) Nimeä kaksi elementtiä, joilla on kaksi valenssielektronia.
b) Ilmoita alkuaine, joka reagoi kiivaasti veden kanssa tuottaen metallihydroksidia.
c) Ilmoita ei-reaktiivinen alkuaine.
d) Ilmoita kaksi alkuaalia, jotka yhdistyvät alkalimetallien kanssa suolojen muodostamiseksi.
Vastaa:
a) B ja J
Kaksi valenssielektronia vastaa ryhmää 2, jolla on ns-elektronikonfiguraatio2 ja heitä edustavat harjoituksessa B ja J.
b) A, B, I tai J.
A ja minä edustamme perheen 1 elementtejä; B ja J ovat perheestä 2. Kuten näimme ominaisuustaulukosta, ryhmän 1 ja 2 elementit ovat hyvin reaktiivisia ja voivat muodostaa hydroksideja, kuten annetuissa esimerkeissä: KOH ja Mg (OH)2.
c) G
Jalokaasut ovat erittäin stabiileja eivätkä siksi kovin reaktiivisia. Kirjain G lisätään taulukkoon osana tätä perhettä.
d) F ja K
Halogeenit reagoivat alkalimetallien kanssa muodostaen suoloja. Yleisin esimerkki tästä on pöytäsuola, NaCl.
2) Seuraava kuva esittää kolme kemiallista alkuaineita vasemmalta oikealle, litium, natrium ja kalium.

Valitse vaihtoehto, joka täyttää kaikki seuraavat lauseet oikein.
1.1) "Voimme sanoa, että litium, natrium ja kalium ...
(A)… kuuluvat samaan ajanjaksoon. "
(B)… on sama atominumero. "
(C)… kuuluvat samaan ryhmään. "
(D)… on sama massanumero. "
1.2) "Alkuaineet litium, natrium ja kalium ...
(A)… on hyvin samanlaisia kemiallisia ominaisuuksia. "
(B)… sillä on hyvin erilaiset kemialliset ominaisuudet. "
(C)… ovat ei-metalleja. "
(D)… reagoi veden kanssa muodostamaan happamia liuoksia. "
Vastaukset:
1.1) (C) kuuluvat samaan ryhmään.
1.2) (A): lla on hyvin samanlaiset kemialliset ominaisuudet.
Voimme saada nämä tiedot tarkastelemalla jaksollista taulukkoa tai jakamalla elektroniset elementit litiumille, natriumille ja kaliumille. Näemme, että kolmella on elektroni valenssikuoressa, ja koska ne ovat osa samaa ryhmää, kemialliset ominaisuudet ovat hyvin samanlaisia.
3) Tarkastellaan seuraavaa taulukkoa, jossa on esitetty joidenkin kemiallisten alkuaineiden atomiluvut ja elektroniset jakaumat.
| Elementti | kemiallinen symboli | atomiluku | Eletroninen jakautuminen |
|---|---|---|---|
| Litium | lukea | 3 | 2,1 |
| Beryllium | olla | 4 | 2,2 |
| Fluori | F | 9 | 2,7 |
| neon | Huh | 10 | 2,8 |
| kloori | Cl | 17 | 2,8,7 |
| argon | Ilmaa | 18 | 2,8,8 |
| Kalium | K | 19 | 2,8,8,1 |
| Kalsium | Tässä | 20 | 2,8,8,2 |
Ilmoita kunkin elementin ryhmä.
Vastaa:
Litium ja kalium: ryhmä 1. (Heillä on elektroni valenssikuoressa).
Beryllium ja kalsium: ryhmä 2. (Heillä on kaksi elektronia valenssikuoressa).
Fluori ja kloori: ryhmä 17. (Heillä on seitsemän elektronia valenssikuoressa).
Neon ja argon: ryhmä 18. (Heillä on kahdeksan elektronia valenssikuoressa).
Tarkista pääsykokeen kysymykset kommentoidulla tarkkuudella Jaksollisen harjoitukset ja julkaisemattomat kysymykset aiheesta Harjoitukset jaksollisen järjestelmän järjestämiseen.