Yksi puskuriliuos se on seos, jota käytetään estämään väliaineen pH: n tai pOH: n muutos, kun lisätään vahvoja happoja tai vahvoja emäksiä.
Puskuriliuoksia on kahta tyyppiä:
1. Seos heikkoa happoa sen konjugaattiemäksen kanssa;
2. Seos heikkoa emästä sen konjugaattihapon kanssa.
Katsotaanpa esimerkkejä kustakin ja miten ne toimivat, kun väliaineeseen lisätään pieni määrä vahvaa happoa tai emästä:
1. Heikon hapon ja sen konjugaattiseoksen seos:
Tällaisen liuoksen muodostamiseksi heikko happo sekoitetaan saman anionin suolan kanssa kuin happo.
Tarkastellaan esimerkiksi etikkahaposta (H3COCOOH(tässä)) ja natriumasetaatilla (H3COCOONas). Katso, että molemmilla on asetaattianioni: (H3CCOO-(tässä)). Näiden ionien pitoisuus johtuu käytännössä suuren suolan dissosiaatiosta. Happoionisaatio on pieni.

Huomaa nyt, mitä tapahtuu seuraavissa lisäysmahdollisuuksissa:
- Pieni määrä vahvaa happoa:
Vahvan hapon lisääminen lisää hydroniumionin H pitoisuutta3O+1ja koska etikkahappo on heikko happo, asetaattianionilla on suuri affiniteetti protoniin (H
+) hydronium. Tällä tavoin ne reagoivat ja muodostuu enemmän etikkahappoa:
Tämän seurauksena väliaineen pH ei käytännössä muutu. Jos kuitenkin lisätään yhä enemmän vahvaa happoa, tulee aika, jolloin kaikki asetaattianionit kulutetaan ja puskurivaikutus lakkaa.
- Pienen määrän vahvan emäksen lisääminen:
Vahvan emäksen lisääminen lisää OH-ionien pitoisuutta-. Mutta H-ionit neutraloivat nämä ionit3O+1 vapautuu etikkahapon ionisaatiossa:

Tämän reaktion myötä H-ionien konsentraatio3O+1(tässä) vähenee ja tasapainossa tapahtuu muutos merkityksessä happo-ionisaation lisäämiseksi, ja siksi liuoksen pH-vaihtelu on hyvin pieni. H-ionien pitoisuus3O+1(tässä) se on käytännössä vakio.
Älä lopeta nyt... Mainonnan jälkeen on enemmän;)
Tässä tapauksessa on myös puskurin rajakapasiteetti. Siksi, jos lisätään yhä enemmän emästä, happo-ionisaation tasapaino siirtyy yhä enemmän kohti sen ionisaatiota, kunnes kaikki happo kuluu.
2. Heikon emäksen seos konjugaattihapolla:
Tämän tyyppinen puskuriliuos koostuu heikosta emäksestä ja suolaliuoksesta, jotka sisältävät saman kationin kuin emäs.
Tarkastellaan esimerkiksi puskuriliuosta, jonka muodostaa magnesiumhydroksidi, MgOH2 (aq) (heikko emäs) ja magnesiumkloridi, MgCl2 (s) (suola). Molemmat sisältävät kationimagnesiumia (Mg2+(tässä)). Väliaineessa läsnä olevat magnesiumionit ovat käytännössä kaikki peräisin suolan dissosiaatiosta, koska emäksen dissosiaatio on heikkoa:
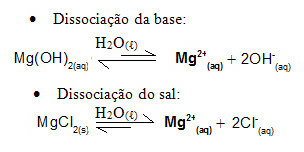
- Pieni määrä vahvaa happoa:
Tässä tapauksessa H-ionit3O+1 voimakkaan hapon lisäyksestä tulevat neutraloivat OH-ionit-, joka tulee heikosta pohjan dissosiaatiosta. Tämä siirtää perushajontatasapainon oikealle.
Siten pH-vaihtelu (jos sellainen on) on hyvin pieni, koska OH-ionien pitoisuus- pysyy vakiona. Puskurivaikutus lakkaa, kun koko emäs erotetaan.
- Pienen määrän vahvan emäksen lisääminen:
Lisätty vahva emäs käy dissosiaatiota vapauttaen OH-ioneja-. Koska magnesiumhydroksidi on heikko emäs, suolasta hajoamalla vapautuvalla magnesiumilla on suurempi taipumus reagoida OH: n kanssa-:

Siksi OH-ionien lisääntyminen- kompensoi Mg: n (OH) suhteellinen kasvu2 (aq). Tämän seurauksena pH: ssa ei tapahdu suuria muutoksia.
Tämä vaikutus loppuu, kun kaikki magnesiumkationi on käytetty.
Kirjailija: Jennifer Fogaça
Valmistunut kemian alalta
Haluatko viitata tähän tekstiin koulussa tai akateemisessa työssä? Katso:
FOGAÇA, Jennifer Rocha Vargas. "Mikä on puskuriliuos?"; Brasilian koulu. Saatavilla: https://brasilescola.uol.com.br/quimica/o-que-uma-solucao-tampao.htm. Pääsy 28. kesäkuuta 2021.
Kemia

Testaa tietosi ja opi lisää tällä luettelolla kemiallisia tasapainoja koskevista ratkaisuista. Tämän materiaalin avulla pystyt ymmärtämään paremmin tasapainovakioiden (Kp, Kc ja Ki), tasapainosiirron, pH: n ja pOH: n sekä tasapainon käyttämisen ns. Puskuriliuoksissa.
Ratkaisu, kiinteä ratkaisu. Nestemäinen liuos, kaasumainen liuos, kaasun ja nesteen muodostamat liuokset, nesteiden muodostamat liuokset.


