Jokapäiväisessä elämässä ja laboratorioissa on reaktioita ja muutoksia, jotka ovat spontaaneja, ja muut, jotka eivät ole spontaaneja. Esimerkiksi kaikki palaminen on spontaania reaktiota, koska aloitettuaan se jatkuu, kunnes kaikki polttoaine on kulunut tai kunnes kaikki happi on loppunut.
Toisaalta elektrolyysi on ei-spontaani prosessi, jossa sähköenergia muuttuu kemialliseksi energiaksi. Esimerkki on natriumkloridin (NaCl) elektrolyysi. Kun sähkövirta johdetaan tämän sulan suolan yli, tapahtuu redoksireaktioita ja muodostuu metallista natriumia (Nas) ja kloorikaasu (Cl2 g)). Jos lopetamme sähkövirran käytön, reaktio ei jatku itsestään, mikä osoittaa, että se ei ole spontaania.
Reaktion spontaanisuus voidaan mitata käyttämällä Gibbs-Helmholtz-yhtälö, annettu alla:

Mistä:
∆G = vapaan energian vaihtelu;
∆H = entalpian muutos;
T = lämpötila kelvineinä (aina positiivinen);
∆S = entropian muutos.
Tämä yhtälö on saanut nimensä, koska sen ehdotti amerikkalainen fyysikko J. Willard Gibbs (1839-1903) ja saksalainen fyysikko Hermann Helmholtz (1821-1894).
Ymmärrämme paremmin, kuinka tämä yhtälö auttaa meitä määrittämään reaktion spontaanisuuden. Tarkastellaan lyhyesti kaikkia siihen liittyviä käsitteitä:
- ∆H (entalpian vaihtelu): Entalpia (H) on aineen energiasisältö. Toistaiseksi ei ole tapaa määrittää sitä. Käytännössä saavutetaan mittaamalla prosessin entalpian variaatio (∆H) kalorimetreillä. Tämä vaihtelu on energia, joka vapautui tai absorboitui prosessissa.
- ∆S (entropian vaihtelu):Entropia (S) on termodynaaminen määrä, joka mittaa häiriöiden astetta järjestelmässä.
Esimerkiksi sulatettaessa jäätä molekyylit siirtyvät kiinteästä tilasta nestemäiseen tilaan, jossa on enemmän epäorganisaatiota. Tämä tarkoittaa, että tässä prosessissa entropia lisääntyi (∆S> 0).
Älä lopeta nyt... Mainonnan jälkeen on enemmän;)
Ammoniakin (NH3), 1 mooli typpikaasua reagoi 3 moolin vetykaasun (toisin sanoen 4 moolin reagoivissa aineissa olevien molekyylien) kanssa, jolloin syntyy 2 moolia ammoniakkia:
N2 g) +3 H2 g) → 2 NH3 g)
Koska kaasufaasissa olevien molekyylien määrä pienenee tässä prosessissa, epäorganisaatio väheni, mikä tarkoittaa, että myös entropia väheni (∆S <0).
- ∆G (vapaa energia): Vapaa energia tai Gibbsin vapaa energia (koska vain tämä tiedemies ehdotti sitä vuonna 1878) on työn tekemiseen käytetyn järjestelmän hyödyllinen energia.
Järjestelmässä on globaalia energiaa, mutta vain murto-osa energiasta käytetään työn tekemiseen, tätä kutsutaan Gibbsin vapaaksi energiaksi, jota symboloi G.
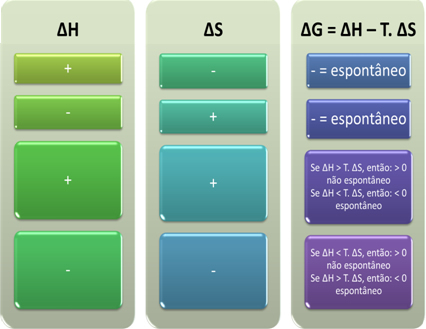
Gibbsin mukaan prosessia pidetään spontaanina, jos se suorittaa työtä, ts. jos G pienenee. Tässä tapauksessa muunnoksen lopullinen tila on vakaampi kuin alkuperäinen, kun ∆G <0.
Tämän perusteella voimme päätellä seuraavaa:

Voimme myös nähdä, onko prosessi spontaani, tarkastelemalla ebH: n ja ∆S: n algebrallista merkkiä Gibbs-Helmholtz-yhtälössä:
Kirjailija: Jennifer Fogaça
Valmistunut kemian alalta
Haluatko viitata tähän tekstiin koulussa tai akateemisessa työssä? Katso:
FOGAÇA, Jennifer Rocha Vargas. "Gibbsin vapaa energia"; Brasilian koulu. Saatavilla: https://brasilescola.uol.com.br/quimica/energia-livre-gibbs.htm. Pääsy 28. kesäkuuta 2021.