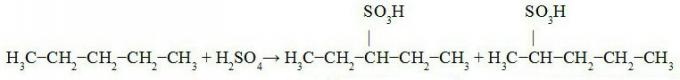O rikkihappo se on väritön, viskoosi, vähän haihtuva neste (kiehumislämpötila: 338 ° C) ja erittäin liukoinen veteen. Ja aine, jota eniten käyttää teollisuudelle, jota käytetään laajasti monipuolisimmissa prosesseissa.
Lue myös: mikä on liukoisuus?
Kaava
O rikkihappo on epäorgaaninen yhdiste ja kovalenttinen molekyylikaavaH2VAIN4. Kun se lisätään veteen, se vapauttaa H-kationin+ ja sulfaattianioni (SO42-) seuraavan kemiallisen yhtälön mukaan:
H2VAIN4 (aq) → 2 H+(tässä) + Käyttöjärjestelmä42-(tässä)
Tämä liukeneminen on erittäin eksotermineneli se vapauttaa suuren määrän lämpöä ja vaatii siksi jonkin verran hoitoa prosessin aikana. Onnettomuuksien välttämiseksi laitamme rikkihappoa aina veteen, eikä koskaan päinvastoin, jotta vapautunut lämpö voidaan haihtua turvallisemmin.
Katso myös: Epäorgaaninen kemia

sovellukset
Suurin osa maailmanlaajuisesti tuotetusta rikkihaposta käytetään fosfaatti- ja sulfaattilannoitteiden valmistus. Tässä ja muissa sovelluksissa rikkihaposta on tullut teollisuuden eniten käytetty aine, ja sitä voidaan pitää indeksinä maan teollisen kehityksen arvioimiseksi.

Rikkihappoa käytetään myös laajalti alumiinisulfaatin tuotanto, yksi tuotteista, joita tarvitaan paperintuotanto. Tämä prosessi tapahtuu rikkihapon ja rikin oksidin välisessä reaktiossa alumiini bauksiittimalmissa:
3 tuntia2VAIN4 + Al2O3 → Al2(VAIN4)3 + 3 H2O
Rikkihappoa on myös läsnä lyijyakut, joita käytetään autoissa, toimii elektrolyyttinä - tuotantoprosessissa sähköä.
Älä lopeta nyt... Mainonnan jälkeen on enemmän;)
Tietää enemmän: Orgaaniset ja epäorgaaniset lannoitteet
Kuten mainittiin, rikkihapolla on monia sovelluksia. Mainittujen lisäksi luetellaan alla muita:
- Maaöljy;
- Valmistus nailonista;
- metallien pinnan esikäsittely metallurgisessa teollisuudessa;
- Happokatalyytti kemialliset reaktiot;
- räjähteiden valmistus;
- Jäteveden käsittely;
- Poista tukokset (joissakin tapauksissa).
Lue myös: Nitraatit, suolat, joita esiintyy hyvin räjähteissä ja lannoitteissa
mistä se löytyy
Rikkihappo johtuu korkeasta liukoisuudesta veteen ei löydy luonnostaan puhtaassa muodossaan. Laimennetussa muodossa se löytyy happosade on päällä mineraalilähteistä peräisin olevia vesistöjä, yleensä sulfidi rautaa.
Teollisuudessa rikkihappoa tuotetaan rikki perus, menetelmällä nimeltä yhteydenottoprosessi, joka tapahtuu kolme vaihetta:
1. vaihe: rikin polttaminen rikkidioksidin tuottamiseksi.
ss + O2 g) → käyttöjärjestelmä2 g)
2. vaihe: rikkidioksidin hapettuminen rikkitrioksidiksi.
2 SO2 g) + O2 g) → 2 käyttöjärjestelmää3 g)
3. vaihe: muodostunut rikkitrioksidi hydratoidaan muodostaen rikkihappoa.
VAIN3 g) + H2O(1) → H2VAIN4 (1)
Katso myös: mikä on happosade?
Kirjailija: Victor Ferreira
Kemian opettaja
Haluatko viitata tähän tekstiin koulussa tai akateemisessa työssä? Katso:
FERREIRA, Victor Ricardo. "Rikkihapon käyttö teollisuudessa"; Brasilian koulu. Saatavilla: https://brasilescola.uol.com.br/quimica/uso-Acido-sulfurico-pela-industria.htm. Pääsy 28. kesäkuuta 2021.