Termologian tutkimuksessa kutsumme sitä adiabaattiset muunnokset ne kaasumaiset muunnokset, joissa ei tapahdu lämmönvaihtoa ulkoisen ympäristön kanssa. Siksi adiabaattisessa muunnoksessa lämpö on nolla.
Q = 0
Jos sovellamme termodynamiikan ensimmäistä lakia, meillä on:
Q = ∆U + τ
∆U = - τ
Mutta mitä se tarkoittaa, että ulkoisen ympäristön välillä ei ole lämmönvaihtoa? Se tarkoittaa, että jos kaasumainen paisuminen tapahtuu ja kaasu suorittaa 300 J: n työn, se ei tee sitä jos väliaineen kanssa tapahtuu lämmönvaihtoa, kaasun sisäisen energian vaihtelu on negatiivinen, joten meillä tulee olemaan:
∆U = - 300 J
Jos nyt kaasun sisäinen energia laskee, voimme sanoa, että myös kaasun lämpötila laski. Kaasujen yleisestä laista

Voimme sanoa, että jos tilavuus kasvaa ja kaasun lämpötila laskee, myös kaasun paine laskee välttämättä. Yleisesti ottaen voimme sanoa, että sama tapahtuu myös puristuksen kanssa, koska jos tapahtuu puristusta, kaasun sisäinen energia kasvaa, joten myös paine kasvaa.
Miellekartta: Adiabaattinen muutos
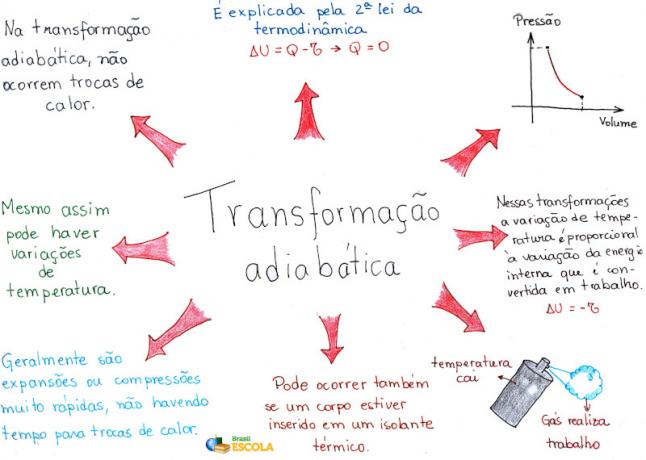
* Voit ladata mielikartan PDF-muodossa. Klikkaa tästä!
Lyhyesti sanottuna voimme sanoa, että:
- adiabaattisessa paisumisessa lämpötilan ja paineen lasku;
- adiabaattisessa puristuksessa lämpötilan ja paineen nousu.
Alla oleva kaavio antaa meille yleiskuvan adiabaattisesta muutoksesta:
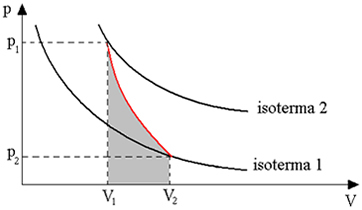
Adiabaattiset muunnokset saadaan käyttämällä lämpöeristettyjä säiliöitä tai myös puristamalla tai erittäin nopeasti laajentamalla.
Siten voimme päätellä, että kun kaasu vaihtaa lämpöä ulkoisen ympäristön kanssa, kestää jonkin aikaa, ennen kuin lämpö etenee kaasumassan läpi ja sen tasapainoon. Siksi, kun sekä paisunta että nopea puristus suoritetaan, käytännössä ei tapahdu lämmönvaihtoa ulkoisen ympäristön kanssa.
* Minun mielikartta, Rafael Helerbrock
Kirjoittanut Domitiano Marques
Valmistunut fysiikasta
Lähde: Brasilian koulu - https://brasilescola.uol.com.br/fisica/estudo-transformacao-adiabatica.htm