
Kalorien määrä riippuu ruoan kokoonpanosta. Joten kokeellisesti määritämme ruoan vapauttaman lämmön määrän, jonka keho voi absorboida, käytämme laitetta nimeltä kalorimetri.
Tämä laite mittaa ruoan vapauttamaa lämpöä sen polttamisen yhteydessä. Kalorimetrejä on useita; ensimmäinen niistä luotiin vuonna 1780 Lavoisier ja Laplace ja oli jääkalorimetri.
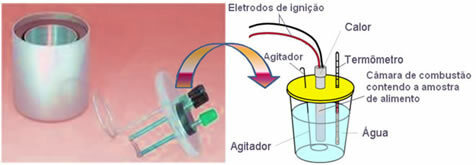
Nykyään eniten käytetty ja joka ottaa huomioon edellä selitetyn kalorikonseptin, on veden kalorimetri. Tämä laite on päällystetty eristävällä materiaalilla lämpöhäviön estämiseksi väliaineesta; ja analysoitava ruoka laitetaan palotilan, joka sisältää happikaasua ja elektrodit. Nämä elektrodit läpikäyvät sähköpurkauksen ja aiheuttavat niiden syttymisen ja ruoan palamisen.
Kalorimetrissä oleva tunnettu vesimassa absorboi palaneen ruoan vapauttaman lämmön ja a lämpömittari mittaa veden lämpötilan nousua. Lisäksi kalorimetri sisältää a sekoitin mikä sallii veden lämpötilan pysyä tasaisena koko sen ajan.
Joten jos käytämme esimerkiksi 1 gramman sokeria ja kalorimetrissä on 1000 g vettä, havaitsemme sen lopulta reaktion jälkeen veden lämpötila nousi 20 ° C: sta 24 ° C: seen, eli se nousi 4 ° C: lla, voimme sitten saavuttaa sokeria. Kuten? No, kun otetaan huomioon alkuperäinen kalorikonsepti, meillä on:
| Nosta 1 ° C: sta → 1 cal / gramma vettä |
| Nosta 4 ° C → 4 cal / gramma vettä |
Joten 1 g vettä imee 4 kalkkia. Vettä käytettiin kuitenkin 1000 g, ja kun otetaan huomioon, että se absorboi kaiken palamisen aikana vapautuneen lämmön, veden absorboima kokonaisenergia oli 4000 cal tai 4 kcal. Siksi päätellään, että:
| Sokerin energia-arvo = 4000 cal / g tai 4 kcal / g. |
Siirtyminen SI: ksi:
1 kcal 4,18 kJ
4 kcal / g x
x = 16,72 kJ / g
Lisäksi voimme käyttää seuraavaa yhtälöä laskemaan luovutetun tai veden absorboiman lämmön määrän:
| Q = m. ç. t |
Missä:
Q = veden luovuttama tai absorboima lämpö;
m = veden massa;
c = veden ominaislämpö, joka on 1,0 cal / g. ° C tai 4,18 J / g. ° C;
Δt = veden kärsimän lämpötilan vaihtelu, jonka antaa lopullisen lämpötilan lasku alkuperäisellä (tf - ti).
Tätä kaavaa käyttämällä saadaan sama tulos:
Q = m. ç. t
Q = 1000 g. 1,0 cal / g. ° C. (24 - 20) ° C
Q = 4000 cal
Q = 4,0 kcal
tai
Q = m. ç. t
Q = 1000 g. 4,18 kJ / g. ° C. (24 - 20) ° C
Q = 16,72 kJ
Kirjailija: Jennifer Fogaça
Valmistunut kemian alalta
Lähde: Brasilian koulu - https://brasilescola.uol.com.br/quimica/medindo-as-calorias-dos-alimentos-por-meio-um-calorimetro.htm

