aktiiviset isomeerit tai optisesti aktiiviset isomeerit (IOA) ovat tietyn kemiallisen aineen molekyylejä, jotka voivat suorittaa polarisaation ja poikkeaman suunnitelma kevyt oikea vai vasen. Tarkista, onko aineella aktiivisia isomeerejä, tarkista vain, onko sen rakennekaavassa epäsymmetristä hiiltä:

Analysoimalla yllä olevassa kuvassa esitettyä ketjua voimme nähdä, että keskihiilellä on neljä erilaista ligandia (OH, H, CH3 ja Cl), mikä tekee siitä a hiili epäsymmetrinen, jota kutsutaan myös hiileksi kiraalinen. Siten aina, kun ketjussa on yksi tai useampi kiraalinen hiili, on aktiivisia isomeerejä.
Sinä aktiivisten isomeerien tyypit(IOA) he ovat:
Oikeakätinen: Aktiivinen optinen isomeeri, joka taivuttaa polarisoitunutta valoa oikealle;
Levogiro: Aktiivinen optinen isomeeri, joka taivuttaa polarisoitunutta valoa vasemmalle.
Havainto: Asymmetrisen hiilen läsnäolo rakennekaavassa osoittaa, että aineella on oltava kääntyvä isomeeri ja kääntyvä isomeeri. Ei ole meidän tehtäväsi tietää, mihin suuntaan valo heijastui, koska kiraalisen hiilen läsnäolo todistaa jo tämän tosiasian. Aina puolet olemassa olevista molekyyleistä on vasenkätisiä ja toinen puoli oikeakätisiä.
Minkä tahansa orgaanisen aineen vasenkätisillä ja oikeakätisillä molekyyleillä on aina samat fysikaaliset ominaisuudet (piste) sulamispiste, kiehumispiste, tiheys, liukoisuus jne.), mutta niillä on kemiallisia vaikutuksia (käyttäytyminen organismissa) monta erilaista. Esimerkki on adrenaliini. Ainoastaan adrenaliinilevogyramolekyyli toimii kehossa, kun taas dekstrogyrat eivät.
Katso nyt butan-2-oli-aineen rakennekaavasta tarkistaaksesi, onko sillä aktiivisia isomeerejä:
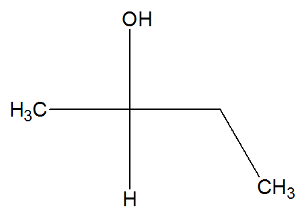
Butan-2-olin rakenteessa voidaan havaita, että hiili 2: lla on neljä erilaista sideainetta (OH, H, CH3, CH2-CH3), joten se on kiraalinen hiili ja esittää dekstrotoratorisesti aktiivista isomeeriä ja toista levorotary aktiivista isomeeriä.
Aktiivisten isomeerien (IOA) laskeminen
Hollantilainen kemisti Jacobus Henricus van't Hoff kehitti kaavan, jonka avulla voidaan laskea, kuinka monta aktiivista isomeeriä (IOA) tietty aine voi olla. Katso:
IOA: 2ei
n: on kiraalisten hiilien lukumäärä aineen rakennekaavassa.
Seuraa kahta esimerkkiä Vant't Hoff -kaavan soveltamisesta:
5-dikloori-2,3-dihydroksiheksaanidihappo

Yhdisteen rakennekaavassa on kolme kiraaliset hiilet tai epäsymmetrinen, siksi:
IOA = 2ei
IOA = 23
IOA = 8
2,3,4,5-tetrahydroksiheksanaali

Yhdisteen rakennekaavassa on neljä kiraaliset hiilet (punaiset nuolet) tai epäsymmetrinen, siksi:
IOA = 2ei
IOA = 24
IOA = 16
Havainto: On mahdollista, että rakennekaavassa on kaksi epäsymmetristä hiiltä, joilla on täsmälleen samat ligandit. Jos näin tapahtuu, otamme laskelmissa huomioon vain arvon n n, ei 2. Katso esimerkki:
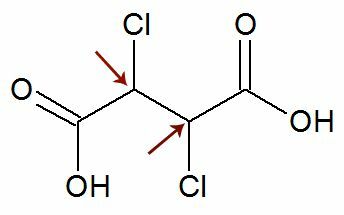
Kuten kaksi kiraalista hiiltä he ovat on yhtä suuri, pidämme vain yhtä hiili laskennassa:
IOA = 2ei
IOA = 21
IOA = 2
Minun luona. Diogo Lopes Dias
Lähde: Brasilian koulu - https://brasilescola.uol.com.br/quimica/isomeros-ativos.htm
