Haje se on järjestelmän häiriöasteen mittari, joka mittaa energian saatavuutta.
Se on fyysinen määrä, joka liittyy Toinen termodynamiikan laki ja että sillä on taipumus kasvaa luonnollisesti maailmankaikkeudessa.
Määritelmä Entropia
"Häiriötä" ei tule ymmärtää "sotkuksi", vaan pikemminkin järjestelmän organisaation muodoksi.
Entropian käsitettä käytetään joskus muilla tietämysalueilla tällä häiriötunnelmalla, joka on lähempänä tervettä järkeä.
Kuvitellaan esimerkiksi kolme purkkia, joista toisessa on pieniä sinisiä marmoreita, toisessa saman tyyppisiä marmoreita, mutta punaisia ja kolmannessa tyhjiä.
Otamme tyhjän potin ja laitamme kaikki siniset pallot alle ja kaikki punaiset pallot päälle. Tässä tapauksessa pallot erotetaan ja järjestetään väreillä.
Ravistamalla pottia pallot alkoivat sekoittua siten, että tietyllä hetkellä alkuerotusta ei enää ole.
Vaikka jatkamme potin ravistamista, on epätodennäköistä, että pallot palaavat samaan alkuperäiseen organisaatioon. Eli järjestetystä järjestelmästä (värillä erotetut pallot) on tullut häiriintynyt järjestelmä (sekapallot).

Luonnollinen taipumus on siis lisätä järjestelmän häiriötä, mikä tarkoittaa entropian lisääntymistä. Voidaan sitten sanoa, että järjestelmissä: ΔS> 0, missä S on entropia.
Ymmärrä myös mikä se on entalpia.
Entropia ja termodynamiikka
Entropian konseptin alkoi kehittää ranskalainen insinööri ja tutkija Nicolas Sadi Carnot.
Tutkimuksessaan mekaanisen energian muuttumisesta lämpöksi ja päinvastoin hän havaitsi, että olisi mahdotonta olla lämpökone, jolla olisi kokonaishyötysuhde.
THE Ensimmäinen termodynamiikan laki periaatteessa määrittää, että "energiaa säästetään". Tämä tarkoittaa, että fyysisissä prosesseissa energia ei häviä, se muuttuu tyypistä toiseen.
Esimerkiksi kone käyttää energiaa työn tekemiseen ja siinä prosessissa kone lämpenee. Toisin sanoen mekaaninen energia hajoaa lämpöenergiaksi.
Lämpöenergia ei muutu takaisin mekaaninen energia (jos näin tapahtuisi, kone ei koskaan kaatuisi), joten prosessi on peruuttamaton.
Myöhemmin Lord Kelvin täydentänyt Carnotin tutkimusta termodynaamisten prosessien peruuttamattomuudesta ja synnyttänyt Toinen termodynamiikan laki.
Rudolf Clausius käytti ensimmäisenä termiä Entropia vuonna 1865. Entropia olisi mitan määrä Lämpöenergia jota ei voida muuttaa mekaaniseksi energiaksi (ei voi tehdä työtä) tietyssä lämpötilassa.
Clausius kehitti matemaattisen kaavan entropian () S muunnelmalle, jota tällä hetkellä käytetään.
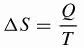
Oleminen,
ΔS: entropian vaihtelu (J / K)
K: lämmönsiirto (J)
T: lämpötila (K)
Lue myös:
- Termodynamiikka
- Carnot-sykli
- Energia
- Energiatyypit
- Fysiikan kaavat
Ratkaistut harjoitukset
1) Enem - 2016
Vuoteen 1824 asti uskottiin, että lämpökoneilla, joista esimerkkejä ovat höyrykoneet ja nykyiset polttomoottorit, voi olla ihanteellinen toiminta. Sadi Carnot osoitti, että kahden lämpölähteen (yksi kuuma ja toinen kylmä) välillä toimivan lämpökoneen mahdottomuus saavuttaa 100%: n hyötysuhde. Tällainen rajoitus tapahtuu, koska nämä koneet
a) suorittaa mekaanista työtä.
b) tuottaa lisääntynyttä entropiaa.
c) käyttää adiabaattisia muunnoksia.
d) rikkovat energiansäästölakia.
e) toimittava samassa lämpötilassa kuin kuuma lähde.
Vaihtoehto: b) tuottaa lisääntynyttä entropiaa.
2) Enem - 2011
Moottori voi toimia vain, jos se saa jonkin verran energiaa toisesta järjestelmästä. Tällöin polttoaineeseen varastoitu energia vapautuu osittain palamisen aikana, jotta laite voi toimia. Kun moottori käy, osaa palamisen aikana muunnetusta tai muunnetusta energiasta ei voida käyttää työn tekemiseen. Tämä tarkoittaa, että energiaa vuotaa toisessa muodossa. Carvalho, A. X. Z.
Lämpöfysiikka. Belo Horizonte: Pax, 2009 (mukautettu).
Tekstin mukaan moottorin käytön aikana tapahtuvat energiamuutokset johtuvat a
a) lämmön vapautuminen moottorin sisällä on mahdotonta.
b) moottorin suorittama työ on hallitsematonta.
c) lämmön muuntaminen työhön on mahdotonta.
d) lämpöenergian muuttuminen kinetiikaksi on mahdotonta.
e) polttoaineen mahdollista energiankulutusta ei voida hallita.
Vaihtoehto: c) lämmön ja työn muuttaminen kokonaan on mahdotonta.
Katso myös: Harjoituksia termodynamiikasta


