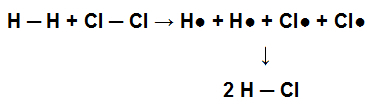THE sitova energia on mukana tauollataiharjoituksissa yhden tai useamman sidoksen molekyylin atomien välillä. Esimerkiksi vetykaasumolekyylillä on yksittäinen sidos (sigma) mukana olevien atomien välillä:

Vetykaasun rakennekaava
Jotta tämä molekyyli olisi syntynyt, muodostui yksittäinen sidos atomiensa välillä. Kun tämä molekyyli osallistuu kemialliseen reaktioon kloorikaasun (Cl2) esimerkiksi kloorivetyhapon (HCl) muodostamiseksi H: ssä läsnä olevat yksittäiset sidokset2 ja Cl: ssä2 täytyy rikkoa, minkä seurauksena yksittäinen sidos muodostuu HCl: ssä.

Esitys yksittäisten sidosten hajoamisesta reagenssissa ja yksittäisen sidoksen muodostumisesta tuotteessa
Atomit sitoutuvat yhteen saavuttaakseen niiden sähköinen vakauseli ne siirtyvät korkeammasta energiatilanteesta alempaan energiatilanteeseen. Siten voimme sanoa, että kun atomien välinen sidos muodostuu, energia vapautuu; sen vuoksi sen hajoaminen riippuu energian absorboinnista.
Jos ymmärrämme sen ero (katkeaminen) kemiallinen sidos tapahtuu, kun se syötetään siihen
energiamäärä (xKcal), päädyimme siihen, että tämä on prosessi endoterminen. Sitä vastoin sidoksen muodostamiseen liittyy vapauta antaa sama määrä energiaa (-xkcal), on sitten prosessi eksoterminen.Kuten kemialliset reaktiot luokitellaan endoterminen tai eksoterminen, voimme käyttää tietoa reagenssien ja tuotteiden molekyylien sitoutumisenergiasta kemiallisen prosessin energiamuutoksen (ΔH) määrittämiseksi ja sen luokittelemiseksi.
Katso esimerkiksi alla oleva yhtälö:

Kemialliset sidokset kemiallisen yhtälön osallistujissa
Meillä on yksinkertaiset linkit jokaisessa reaktion osallistujassa. Heillä on seuraavat arvot:
[A-B] = 50 Kcal
[CD] = 100 Kcal
[B-D] = 80 Kcal
[Eaa.] = 230 Kcal
Yllä olevien arvojen avulla voimme laskea energian, joka liittyy reagoivien sidosten rikkoutumiseen ja tuotteiden sidosten muodostamiseen seuraavasti:
Reagensseissa
50 Kcal AB-sidoksen rikkomiseksi ja 100 Kcal rikkoa CD-sidokseneli reagenssissa 150 Kcal käytetään sidosten rikkoutumiseen.
Tuotteissa
80 Kcal BD-sidoksen muodostamiseksi ja 230 Kcal AC-sidoksen muodostamiseksieli 310 Kcal vapautuu tuotteesta sidosten muodostuessa
Reagensseihin ja tuotteisiin liittyvien energioiden arvojen perusteella on mahdollista tietää, onko reaktio absorboitunut vai ei vapautti enemmän energiaa vain vähentämällä häiriössä käytetyn energian energiasta muodostus:
ΔH = reagenssien energia - tuotteiden energia
ΔH = 230 - 310
ΔH = -80 Kcal
Koska reaktiossa vapautuu enemmän energiaa kuin absorboituu, negatiivinen AH on siksi eksoterminen.
MERKINTÄ: Jos osallistujan stöhkiometrinen kerroin eroaa 1: stä, meidän on kerrottava yhteyden energia-arvo kertoimella, esimerkiksi:

HCl-muodostumisen yhtälö
Koska HCl-kerroin on 2, meidän on kerrottava HCl: n sitoutumisen arvo 2: lla.
Noudata nyt harjoituksen päätöslausetta energian sitomisesta kemiallisessa reaktiossa:
Esimerkki: Kun otetaan huomioon seuraavat sitoutumisenergiat, kilojouleina sidemoolia kohden (absoluuttiset arvot):
H - H = 436
N = N = 945,6
N - H = 391
Laske lämpö (kilojouleina NH-moolia kohti)3 g)) mukana reaktiossa, jota edustaa:

Kemialliset sidokset NH-muodostumisreaktiossa3
Resoluutio:
Ensimmäinen vaihe tämän tehtävän ratkaisemisessa on kirjoittaa annettu yhtälö uudestaan osoittamalla kussakin molekyylissä olevat kemialliset sidokset:
Ei2: meillä on kolmoissidos (koska N, typpiperheen, on muodostettava kolme sidosta, koska sen valenssikuoressa on viisi elektronia);
kohdalla H2: Meillä on yksi sidos (koska H: n on tehtävä vain yksi sidos, koska sillä on vain yksi elektroni valenssikuoressa);
NH: ssä3: Meillä on kolme yksinkertaista sidosta (koska kukin H tarvitsee sidoksen ja N kolme sidosta).

Yhtälö, joka osoittaa linkit NH-muodostumisessa3
Koska harjoitus antoi arvot jokaiselle sitoutumiselle, ensimmäinen vaihe on määrittää kutakin osallistujaa koskeva sitoutumisenergia:
- Pohjoiseen2
Meillä on 1 mooli sisään N2yhtälössä ja yhteyden katkaisemiseksi tarvitsemme 945,4 KJ, joten:
1.945,4 = 945,4 KJ
- H: lle2
Meillä on 3 mol sisään H2yhtälössä ja yhteyden katkaisemiseksi tarvitsemme 436 KJ, joten:
3.346 = 1038 KJ
- NH: lle3
Meillä on 2 mol NH: ta3yhtälössä, mutta N-H-sidos on kolminkertainen, joten kerrotaan sidoksen muodostamiseen liittyvä energiamäärä kahdella ja kolmella:
2.3.391 = 2346 KJ
Lopuksi voimme määrittää reaktioon liittyvän lämmön vähentämällä reaktantin hajottamiseen käytetyn energian tuotteen muodostumisesta vapautuvasta energiasta:
ΔH = energia reagoivissa aineissa - energia tuotteissa
ΔH = (945,4 + 1038) - 2346
ΔH = 1983,4 - 2346
ΔH = - 362,6 KJ / mol NH3 g)
Koska vaihtelu oli negatiivinen, se tarkoittaa, että tuotteiden sidosten muodostumisessa vapautunut energia oli suurempi kuin reagoivien sidosten rikkomisessa absorboitu energia. reaktio on eksoterminen.
Minun luona. Diogo Lopes Dias
Lähde: Brasilian koulu - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-energia-ligacao.htm