THE Oktettiteoria toteaa, että kemiallisen alkuaineen atomin ollessa vakaa, sen on hankittava jalokaasun elektroninen konfiguraatio, toisin sanoen sillä on oltava kahdeksan elektronia valenssikuoressa tai kaksi elektronia, jos atomilla on vain ensimmäinen elektronikuori. (K).
Berylliumin atomiluku on 4. Siksi atomissasi on 4 elektronia ja sen elektronisen jakauman perustilassa antaa:

Berylliumin elektroninen kokoonpano
Tämä tarkoittaa, että berylliumin viimeisessä kuoressa on 2 elektronia, jotka kuuluvat 2A-perheeseen (maa-alkalimetallit). Siten sillä olisi taipumus lahjoittaa nämä kaksi elektronia saaden varaus 2+, ts. Sillä olisi taipumus muodostaa ionisidoksia.
Havaitaan kuitenkin, että berylliumatomit muodostavat kovalenttisia sidoksia, joissa elektroni jakautuu, kuten alla muodostetussa yhdisteessä näkyy,2):
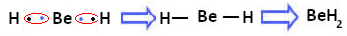
Berylliumin kovalenttisten sidosten muodostuminen vedyn kanssa
Huomaa, että tässä tapauksessa beryllium on stabiili, kun sen valenssikuoressa on alle kahdeksan elektronia, koska jakaa elektroninsa kuten vetyatomit, sillä on nyt neljä elektronia viimeisessä kerros. Siksi on a
poikkeus oktettisäännöstä.Mutta kovalenttinen sitoutuminen tapahtuu yleensä, koska elementillä on epätäydellisiä orbitaaleja. Esimerkiksi, kuten alla on esitetty, vedyllä on epätäydellinen kiertorata, joten se muodostaa vain yhden kovalenttisen sidoksen. Hapella on kaksi epätäydellistä kiertorataa ja se muodostaa kaksi kovalenttista sidosta. Typpillä on puolestaan kolme epätäydellistä kiertorataa ja siten se muodostaa kolme kovalenttista sidosta:
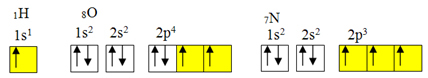
Elektroniset vety-, happi- ja typpijakaumat
Kuten jo osoitettiin, berylliumilla ei ole epätäydellisiä orbitaaleja.
Joten miksi se tekee kovalenttisia sidoksia?
Selitys on hybridisaatioteoria, joka sanoo sen kun elektroni kiertoradalta vastaanottaa energiaa, se “hyppää” syrjäisimmälle tyhjälle kiertoradalle, pysyminen viritetyssä tilassa ja siten keskeneräisten atomirataalien fuusio tai sekoittuminen tapahtuu, tuottaa hybridi kiertoradat jotka vastaavat toisiaan ja eroavat alkuperäisistä puhtaista kiertoradoista.
Esimerkiksi berylliumin tapauksessa alatason 2 elektroni vastaanottaa energiaa ja siirtyy alatason 2p kiertoradalle, joka oli tyhjä:

Beryllium viritti hybridi-orbitaalien muodostumisen
Tällä tavoin berylliumilla on kaksi epätäydellistä orbitaalia, jotka pystyvät muodostamaan kaksi kovalenttista sidosta.
Huomaa, että toinen kiertorata on "s" -tasossa ja toinen "p" -tasossa, joten berylliumin suorittamien sidosten tulisi olla erilaisia. Näin ei kuitenkaan tapahdu, koska hybridisaatio, nämä muodostuneet epätäydelliset orbitaalit sekoittuvat ja muodostavat kaksi kutsuttua orbitaalia hybridit tai hybridisoitu, jotka ovat yhtä suuria keskenään. Lisäksi koska nämä kaksi hybridi-orbitaalia ovat peräisin s-orbitaalista ja p-orbitaalista, sanomme, että tämä hybridisaatio on tyyppiä sp:

Beryllium sp -hybridisaation muodostuminen
Koska hybridi-orbitaalit ovat samat, berylliumin vetyatomien kanssa tekemät kovalenttiset sidokset ovat myös samat:

Hybridi-beryllium-orbitaalien ja vety-orbitaalien läpäisy
Huomaa, että se muodostaa sitten kaksi sigmasidosta, jotka ovat tyypin s-sp (σs-sp).
Kirjailija: Jennifer Fogaça
Valmistunut kemian alalta
Lähde: Brasilian koulu - https://brasilescola.uol.com.br/quimica/hibridizacao-berilio.htm


