kemiallinen alkuaine fosfori (P) kuuluu jaksollisen järjestelmän kolmanteen jaksoon ja typpi (VA) -perheeseen. Tästä syystä sen atomit muodostavat yleensä kolme kemialliset sidokset päästä oktettiteoria (vakaus). On kuitenkin tilanteita, joissa fosforiatomi muodostaa enemmän kuin kolme sidosta, mikä on mahdollista vain hybridisaatioilmiö.
Ymmärtää fosforin hybridisaatio, meidän on ensin ymmärrettävä, miksi tämän elementin atomi muodostaa kolme sidosta. Tätä varten meidän on vain seurattava sähköistä jakelua:

Sähköinen fosforin jakelu
Voimme havaita, että valenssikerroksessa fosforiatomilla on täydellinen 3s-alataso (kanssa kaksi elektronia) ja epätäydellisellä 3p: n alatasolla (kullakin kolmesta p alatason orbitaalista on a elektroni). Alla on elektronien jakauma alatasojen kiertoradoilla Fosforin valenssikerros:
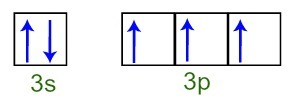
Esitys fosforiatomin valenssikuorielektroneista
Koska kukin 3p: n alatason orbitaaleista on epätäydellinen, fosforiatomi pystyy muodostamaan kolme kemiallista sidosta saavuttaen siten vakauden.
Nyt kun tarkastelemme ainetta PCl5esimerkiksi olemme varmoja, että tässä molekyylissä fosfori kävi läpi hybridisaation, koska se muodosti viisi yhteyttä. Koska VIIA-perheeseen kuuluva kloori tarvitsee sidoksen pysyvän vakaana ja molekyylillä on tästä viisi atomia elementin, jokaisen on muodostettava sidos, joka saa fosforiatomin puolestaan myös muodostamaan viisi Liitännät. Tämä esiintyminen on mahdollista vain fosforin hybridisaatio (epätäydellisten atomirataiden yhdistyminen).
Kun vastaanotetaan energiaa ulkoisesta ympäristöstä, fosforiatomin elektronit innostuvat. Pian sen jälkeen yksi kolmesta 3s-alatasoon kuuluvasta elektronista siirtyy tyhjälle orbitaalille, joka on läsnä d-alatasossa, jolla ei siihen asti ole elektronia. Katso alla oleva kaavio:
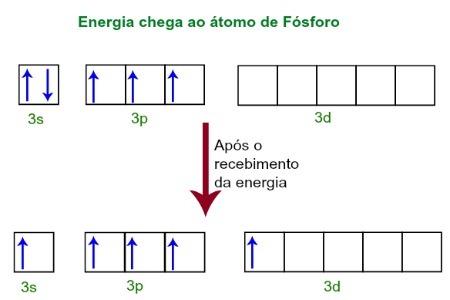
Vastaanotettuaan energiaa fosforin elektronit ovat innoissaan ja yksi vie kiertoradan d-alatasosta.
Tällä hetkellä meillä on fosforin valenssikerroksessa s orbitaali, kolme p orbitaalia ja epätäydellinen d orbitaali.Viime kädessä nämä viisi orbitaalia hybridisoituvat, toisin sanoen yhdistyvät, mikä johtaa viiteen epätäydelliseen atomirataaliin, jotka pystyvät nyt muodostamaan viisi kemiallista sidosta.

Epätäydellisten fosforin atomirataalien hybridisaatio
Kun orbitaali, kolme p orbitaalia ja d orbitaali yhdistettiin, fosfori-hybridisaatio on tyyppiä sp3d.
Minun luona. Diogo Lopes Dias
Lähde: Brasilian koulu - https://brasilescola.uol.com.br/quimica/hibridizacao-fosforo.htm

