THE teneso (tai tennesso), symboli Ts, on elementti määrä atomi- jaksollisen järjestelmän 117. Sen löytö oli hyvin tuore, vuonna 2009, ja se sisällytettiin jaksolliseen järjestelmään vasta vuoden 2015 lopussa. Sitä ei esiinny luonnossa minkään isotoopin muodossa, ja siksi se on tuotettava laboratoriossa, koska se on siksi synteettinen kemiallinen alkuaine.
Tennesson ominaisuuksia tutkitaan edelleen teoreettisen kemian ja matemaattisten laskelmien avulla sen alhaisen tuotantonopeuden vuoksi. Sen tuotanto tapahtuu reaktion kautta 48Ca ja 249Bk, koska on mahdollista tuottaa alkuaineen 294 tai 293 isotooppi.
Nimi viittaa Yhdysvaltojen Tennesseen osavaltioon, josta eräät isotoopin löytämiseen ja tuotantoon osallistuneet tutkijat ovat peräisin. 249Bk, niin tärkeä tämän uuden alkuaineen synteesille.
Katso myös: Bohrium on toinen synteettinen kemiallinen alkuaine, jonka tuotantoaste on alhainen
tennesson yhteenveto
Tenesso on synteettinen kemiallinen alkuaine, joka sijaitsee ryhmän 17 Jaksollinen järjestelmä.
Se syntetisoitiin ensimmäisen kerran vuonna 2009 venäläisten ja amerikkalaisten tutkijoiden yhteisessä työssä.
Saksalaiset tutkijat vahvistivat sen itsenäisesti.
Se muodostaa elementtien ryhmän, jotka viimeksi sisällytettiin jaksolliseen järjestelmään vuonna 2016.
Niiden tutkimukset ovat vielä hyvin tuoreita ja niiden ominaisuuksia määrätään matemaattisin menetelmin.
Sen tuotanto on Ydinfuusio, käyttämällä ioneja 48Ca ja sen atomit 249bk.
Sen nimi viittaa Yhdysvaltain Tennesseen osavaltioon.
Älä lopeta nyt... Mainoksen jälkeen on muutakin ;)
tennesson kiinteistöjä
Symboli: Ts.
Atominumero: 117.
Atomimassa: 293 c.u. tai 294 c.u. (ei Iupacin virallinen).
Sähköinen konfigurointi: [Rn] 7s2 5f14 6d10 7p5.
Vakain isotooppi:294Ts (51 millisekuntia puolikas elämä, joka voi vaihdella 38 millisekuntia enemmän tai 16 millisekuntia vähemmän).
Kemiallinen sarja: ryhmä 17, halogeenit, superraskaat alkuaineet.
Tenesson ominaisuuksia
Tennesso (tai tennesso), symboli Ts, oli yksi neljästä viimeisestä virallisesta osasta kansainvälisen puhtaan ja sovelletun kemian liiton (IUPAC) jaksollisessa taulukossaan. Ympäristönumerolla 117 se sijaitsee ryhmässä 17 halogeenit.
Sitä valmistettiin ensimmäisen kerran vuosina 2009-2010, mutta Iupac vahvisti sen vasta 30. joulukuuta 2015. Tämän kokoiset alkiot atomiluku ja lukumäärä neutroneja ei löydy luonnosta, ja ne on luotava laboratoriossa, joten se on a synteettinen kemiallinen alkuaine.
Suurin syy, miksi niitä ei esiinny luonnossa, on se, että ne ovat erittäin epävakaita. Kun ne on tuotettu ydinreaktioiden kautta, ne käyvät läpi radioaktiivinen hajoaminen muutamassa sekunnissa (joskus vähemmän kuin millisekunnin alueella).
Lisäksi elementit, kuten T: t, tuotetaan hitaasti vähäinen tuotto. Erityisesti tenesson tapauksessa tutkijat pitivät reaktiota 70 päivän ajan havaitakseen tämän alkuaineen kuusi atomia.
Siksi tällä hetkellä tutkijat yrittävät määrittää Ts: n ja joidenkin sen yhdisteiden perusominaisuudet teoreettisten laskelmien ja matemaattisten mallien avulla. Vuonna tehdyssä ja julkaistussa tutkimuksessa Kemiallisen fysiikan kirjaimet, brasilialainen tutkija Robson Fernandes de Farias arvioi joitakin Ts: n fysikaalisia ominaisuuksia ja tennesso, TsH, kuten kovalenttinen säde, polarisoitavuus, kovalenttisen sidoksen etäisyys sekä sidosenergia kovalenttinen.
Tietää enemmän: Oganessoni — kemiallinen alkuaine, jonka atomiluku on suurin jaksollisessa taulukossa
saada teneso
Superraskaat elementit, kuten teneso, saadaan tekniikalla nimeltä kuuma fuusioreaktio (ilmainen käännös kuuma fuusioreaktio). Tässä tekniikassa on yleistä käyttää ioneja 48Ca, stabiili isotooppi kalsiumia, jonka luonnollinen runsaus on 0,2 % ja kahdeksan neutronia enemmän kuin perinteinen isotooppi.
Ts: lle ionit 48Ca reagoi isotoopin kanssa 249Bk, aktinidi. Näin ollen aluksi 297Ts, joka hajosi nopeasti ja menetti kolme tai neljä neutronia muodostaen isotooppeja 294Ts ja 293Ts.
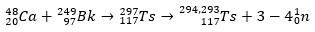
Kaikki tämä oli mahdollista varmistaa α-hajoamisketjujen analyysi, joka saavutti dubnium ja röntgen. Koska saadut Ts-isotoopit ovat epästabiileja, ne käyvät läpi spontaanisti α-hajoamisreaktioita, tai eli ne lähettävät α-hiukkasta (jossa on kaksi protonia ja kaksi neutronia), kunnes ne saavuttavat vakaat ytimet.
Hajoamispolun avulla tiedemiehet pystyivät kokoamaan palapelin ja siten vahvistamaan superraskaan elementin olemassaolon. isotoopille 293Ts, oli kolme α-hajoamista vuoteen asti 281Rg, kun taas isotoopille 294Ts oli kuusi α-hajoamista arvoon 270DB
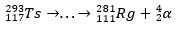
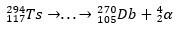
teneson historiaa
Elementti 117, ensimmäistä kertaa, syntyi laajan kansainvälisen yhteistyön kautta venäläisten ja amerikkalaisten tutkijoiden välillä, joka tapahtui Flerov Laboratory for Nuclear Reactions (FLNR) tiloissa, joka sijaitsee Joint Institute for Nuclear Researchissa Dubnan kaupungissa Venäjällä.
On huomionarvoista, että itsenäisesti saksalaiset tutkijat vahvistivat tulokset edelleen Helmhotz Center for Research on Heavy Ions (GSI), joka sijaitsee Darmstadtissa Saksassa. Vuonna 2009 FLNR: n tutkijaryhmä reagoi 70 päivän aikana 48Ca atomien kanssa 249Bk, jolloin saadaan kuusi atomia alkuaineesta 117. Sitten vuonna 2012 tutkijat onnistuivat saamaan seitsemän alkuaineen 117 atomia.
GSI: n riippumaton vahvistus johtui toisesta yrityksestä: tutkijat yrittivät tuottaa elementtiä 119, joka avaisi jaksollisen järjestelmän kahdeksannen jakson. Tässä tapauksessa ideana oli reagoida ioniin 50Sinulla on tavoite 249bk. Yrityksistä huolimatta tätä elementtiä ei kuitenkaan havaittu neljän kuukauden yrittämisen jälkeen.
Titaani-ionien vaihtaminen 48Ca, GSI: n tutkijat lähtivät etsimään harvinaista mutta tunnettua superraskasta elementtiä varmistaakseen kokeellisen menettelynsä. Siten ne päätyivät syntetisoimaan elementtiä 117, jonka avulla Iupac vahvisti tämän elementin.
THE Nimi tenesso viittaa Yhdysvaltain Tennesseen osavaltioon.Tämä oli tapa paitsi kunnioittaa joidenkin FLNR-kokeisiin osallistuneiden tiedemiesten alkuperää, myös muistaa paikka, jossa isotoopit 249Löydön kannalta ratkaisevan tärkeät Bk: t syntetisoitiin, kun niitä tuotettiin Oak Ridge National Laboratoryssa. Englanniksi elementin nimi on Tennessine, jonka pääte liittyy muihin halogeeneihin: fluori, kloori, bromi, jodi, ja astatiini.
Ratkaistiin harjoituksia tenesolla
Kysymys 1
Tenesso, symboli Ts, on viimeksi halogeenien ryhmään (ryhmä 17) kuuluva alkuaine. Siksi sen odotetaan jaksoittaisten ominaisuuksien perusteella olevan samanlainen kemiallisesti kuin tämän ryhmän alkuaineilla. Siten seuraavista vaihtoehdoista voidaan todeta, että teneso:
A) sisältää kuusi valenssielektronia.
B) on pienin atomisäde tämän ryhmän alkuaineista.
C) on pienin elektronegatiivisuus tämän ryhmän alkuaineista.
D) tarvitsee kolme elektronia saavuttaakseen täyden oktetin.
E) on ryhmän 17 suurin elektroniaffiniteetti.
Resoluutio:
Vaihtoehto C
Ts: ssä on, kuten kaikissa ryhmän 17 alkuaineissa, seitsemän elektronia valenssikerros, jossa valenssikerroksena on 7s-kerros2 7p5. Siten voidaan päätellä, että se tarvitsisi elektronin päästäkseen oktetiin, koska sen valenssikuoressa on seitsemän elektronia.
Koska alkuaine, jolla on eniten elektronikuoria halogeeneista, Ts on myös suurin atomisäde, joka takaa vähemmän elektronien affiniteetti, koska lisätyt elektronit olisivat melko kaukana ytimestä. Pienin säde aiheuttaa myös sen, että tennessolla on alhaisin elektronegatiivisuus kaikista ryhmän 17 alkuaineista.
kysymys 2
Teneso, symboli Ts ja atominumero 117, havaittiin ensin kahden sen isotoopin muodostumisesta: massa 293 ja massa 294. Siten voidaan sanoa, että neutronien lukumäärä 293Ts ja alkaen 294Ts on vastaavasti:
A) 293 ja 294
B) 117 ja 118
C) 177 ja 294
D) 176 ja 177
E) 176 ja 293
Resoluutio:
Vaihtoehto D
Kahden isotoopin neutronien lukumäärä voidaan määrittää seuraavasti:
A = Z + n
A on numero pasta atomi-, Z protonien lukumäärä (atomiluku) ja n on neutronien lukumäärä.
Korvaamalla isotoopin 293, meillä on:
293 = 117 + n
n = 293 - 117
n = 176
Isotooppia 294 varten meillä on:
294 = 117 + n
n = 294 - 117
n = 177
Kirjailija: Stefano Araújo Novais
Kemian opettaja

