THE seaborgium, symboli Sg ja atominumero 106, on synteettinen kemiallinen alkuaine, joka sijaitsee jaksollisen järjestelmän ryhmässä 6. Sen löytö on peräisin vuodelta 1974, ja sen ansioksi on otettu Albert Ghiorson johtama amerikkalainen ryhmä, ja siihen osallistui Glenn Seaborg, jonka nimi sai alkunsa termistä seaborgium. Kuten monet tämän alueen elementit Jaksollinen järjestelmä, seaborgiumin nimi vahvistettiin vasta vuonna 1997 tiederyhmien välisten kiistojen ja neuvottelujen vuoksi.
Vaikka sen tutkimiseen on sitoutuneita tutkijoita, seaborgiumilla on vain vähän käytännön hyötyä. Tämä johtuu tämän alkuaineen isotooppien syntetisointivaikeuksista sekä niiden alhaisesta stabiilisuudesta. Esimerkiksi seaborgiumin stabiilimman isotoopin puoliintumisaika on noin viisi minuuttia.
Katso myös: Dubnium on toinen synteettinen kemiallinen alkuaine jaksollisen järjestelmän ryhmässä 6
Yhteenveto seaborgiumista
- Se on synteettinen kemiallinen alkuaine, joka sijaitsee jaksollisen järjestelmän ryhmässä 6.
- Sen syntetisoi ensimmäisen kerran vuonna 1974 kaksi erillistä ryhmää.
- Se on a radioaktiivinen elementti.
- Seaborgiumista ei tiedetä vielä paljon, koska pysyviä näytteitä tuotetaan harvoin merkittäviä määriä.
- Elementti tehtiin viralliseksi seaborgiumiksi vasta vuonna 1997 tiedemies Glenn Seaborgin kunniaksi.
Älä lopeta nyt... Mainoksen jälkeen on muutakin ;)
seaborgiumin ominaisuudet
- Symboli: Sg.
- Atominumero: 106.
- Atomimassa: 269 c.u.
- Sähköinen konfigurointi: [Rn] 7s2 5f14 6d4.
- Tunnetuimmat isotoopit: 269Sg (5 ± 3 minuutin puoliintumisaika); 271Sg (3,1 ± 1,6 minuutin puoliintumisaika).
- Kemiallinen sarja: ryhmä 6; transaktinidit; superraskaita elementtejä.
Seaborgiumin ominaisuudet
Transaktinidielementeille on ominaista olla radioaktiivinen.. Nämä ovat alkuaineita, joiden atomiluku on suurempi tai yhtä suuri kuin 104 (ruterfordiumista, Rf). Näitä elementtejä etsittiin kuitenkin hillittömästi luonnosta ja teoretisoitiin "vakauden saaresta".

Se edustaisi superraskasta atomialuetta, jossa numero protonit olisi keskimäärin 114, ja elementeillä olisi suuri puolikas elämä (aika, joka tarvitaan näytemassan pudotukseen puoleen), esittelee olevansa elinkelpoinen ja kokeellisiin tutkimuksiin käytettävissä.
Kuitenkin 1950-luvulta lähtien on tehty useita ponnisteluja näiden luonnollisten jälkien löytämiseksi 1980-luvun puolivälissä Georgi Flerov ja Gurgen Ter-Akopian sanoivat, ettei heillä ollut toivoa löytää niitä luonto.
Kuten muidenkin transaktinidielementtien kohdalla, seaborgiumia on vaikea tutkia laajasti. Tämä siksi on mahdollista vain syntetisoidapieniä määriä, joilla onerittäin lyhyt puoliintumisaika, eli niitä on vähän atomeja ja ne kestävät muutaman minuutin.
Tämä mahdollisti sen vahvistamisen, että seaborgium olisi itse asiassa ryhmästä 6, kuten tapahtui yhdisteen SgO2cl2, joka muistutti tietyiltä osin ryhmän stabiilien alkuaineiden, kuten WO: n, analogisia yhdisteitä2cl2 ja MoO2cl2.
Lue myös:Transuraanielementit — keinotekoiset alkuaineet, jotka tulevat uraanin jälkeen jaksollisessa taulukossa
Seaborgiumin hankkiminen
Koska seaborgium on synteettinen alkuaine, on tärkeää huomata, että sitä ei esiinny luonnossa. Sen lisäksi, että on mahdollista syntetisoida vain pieniä määriä, on este seaborgiumin saamiselle sen saaminen vaatii korkean teknologian koneita ja äärimmäisiä olosuhteita.
Atomit, kuten seaborgium, muodostuvat reaktiosta Fuusio kevyempiä atomeja käyttäen ioniset säteet erittäin korkea energia ja ne ovat käytettävissä vain tutkimukseen ympäristöissä, joita pidetään vihamielisinä useimmille kemiallisille järjestelmille: käyttämällä sädettä plasma indusoituu suurissa hiukkaskiihdyttimissä.

Historiallisesti seaborgium syntetisoitiin törmäyksen kautta ioneja18(happi-18), jolla on 249Vrt (californium-249) kohteena. Alkuaineen 106 synteesi vahvistettiin siten alfahiukkasten hajoamisen analyysin avulla.
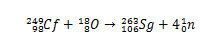
Varotoimet Seaborgiumin kanssa
Kemialliset alkuaineet, kuten seaborgium, eivät aiheuta suuria riskejä, koska tätä alkuainetta ei tuoteta tarpeeksi, jotta se pysyisi vakaana pitkään. Kaikki huolellisuus, joka on otettava huomioon, liittyy radioaktiivisia näytteitä, joita voidaan tuottaa ionisoiva säteily hajoamisprosesseissa.
Tietää enemmän: Tshernobylin onnettomuus – historian suurin ydinonnettomuus
seaborgiumin historiaa
Kuten muutkin erittäin raskaat elementit, seaborgium löydettiin niin kutsutun siirtosodan yhteydessä, pala Kylmä sota historiassa Kemia ja jaksollinen järjestelmä.
Tämä sota oli kiista etusijasta nimeämisessä kemiallisia alkuaineita löydetty fermiumin jälkeen (Fm, Z = 100), tarkemmin sanottuna atominumeroiden 104 - 109 alkuaineiden välillä, jotka tapahtuivat kylmän sodan aikana.
Tässä kiistassa laboratoriot kilpailivat:
- Joint Institute for Nuclear Research Dubnassa (aiemmin osa Neuvostoliitto);
- Lawrence Berkeleyn kansallinen laboratorio Kalifornian yliopistossa Berkeleyssä (Yhdysvallat);
- Gesellschaft für Schwerionenforschung, Darmstadt (Saksa).
Erityisesti seaborgiumin tapauksessa Dubnan ja Berkeleyn laboratorioiden välillä ilmeni kiista. Tämä johtuu siitä, että vuonna 1974 molemmat laboratoriot väittivät onnistuneensa syntetisoimaan alkuaineen 106.
Kuitenkin yhteinen raportti, joka sisälsi jäseniä sekä kansainvälisestä puhtaan ja sovelletun kemian liitosta (IUPAC) että Pure and Applied Physics (Iupap), tehty vuonna 1993, päätteli, että vaikka se on erittäin tärkeä tulevan kehityksen kannalta, sinä Dubnan laboratorioissa tehdyt kokeet eivät osoittaneet elementin 106 muodostumista vakuuttavasti, mikä antaa Berkeley Laboratoriesille uuden elementin löytämisen ansioksi.
Iupac Inorganic Compounds Nomenclature Commission (CNIC) jopa ehdotti rutherfordium-nimeä alkuaineelle 106, jättäen huomiotta tutkijoiden ehdotukset. Pitkän keskustelun jälkeen Berkeley Labs -tiimi, jota johti Albert Ghiorso, päätti nimen osalta kunnioittaa kollegansa Glenn Theodore Seaborgia, PNobel palkinto Chemistry vuonna 1951, ja nimesi alkuaineen seaborgium.
Hänen poikansa Eric Seaborg jopa kertoi artikkelissa isänsä reaktion ajatukseen:
Ghiorso lähestyi joukkueen jäseniä yksitellen, kunnes seitsemän heistä nyökkäsi. Sitten hän kertoi 50-vuotiaalle ystävälleen ja kollegalleen: ”Meillä on seitsemän ääntä sen puolesta, että elementti 106 nimetään seaborgiumiksi. Hyväksytkö?". Isäni oli hämmästynyt ja kuultuaan äitiäni hyväksyi.
Ratkaistiin harjoituksia seaborgiumista
Kysymys 1
Seaborgiumissa on isotooppi, massa 269, jonka arvioitu puoliintumisaika on 5 minuuttia. Sen synteesikokeessa tutkijat pystyivät havaitsemaan 25 minuutin kuluttua 0,0025 mg seaborgiumin isotooppia 269. Seaborgiumin alkuperäinen massa oli:
A) 0,0025 mg
B) 0,0050 mg
C) 0,0100 mg
D) 0,0200 mg
E) 0,0800 mg
Resoluutio:
Vaihtoehto E
Puoliintumisaika on aika, joka kuluu radioaktiivisen näytteen määrän putoamiseen puoleen. 25 minuutin sisällä seaborgiumin puoliintumisaikaa oli viisi. Näin ollen on mahdollista tehdä takautuva analyysi:
- 0,0050 - 0,0025 mg (5. puoliintumisaika)
- 0,0100 - 0,0050 mg (4. puoliintumisaika)
- 0,0200 - 0,0100 mg (3. puoliintumisaika)
- 0,0400 - 0,0200 mg (2. puoliintumisaika)
- 0,0800 - 0,0400 mg (1. puoliintumisaika)
kysymys 2
Vuonna 1974 Berkeleyssä, Kaliforniassa, Albert Ghiorson johtama ryhmä onnistui syntetisoimaan alkuaineen 106 tunnetun siirtosodan aikana, joka oli osa kemian historiassa kylmää sotaa. Tällä uudella alkuaineella oli atomiluvun 106 lisäksi massaluku 263. Vuonna 1997 hänestä tehtiin virallinen seaborgium viitaten Ghiorson ystävään ja kollegaan Glenn Seaborgiin, kemian Nobelin palkinnon saaja vuonna 1951 ja myös jäsen ryhmässä, joka onnistui syntetisoimaan uuden elementti.
Esitetyistä tiedoista voidaan päätellä, että neutronien määrä syntetisoidussa seaborgiumissa on yhtä suuri:
A) 155
B) 157
C) 159
D) 106
E) 263
Resoluutio:
Vaihtoehto B
Lukumäärä neutroneja atomin määrä voidaan laskea seuraavasti:
A = Z + n
A on numero pasta, Z on atomiluku ja n on neutronien lukumäärä.
Korvaamalla kysymyksen antamat tiedot meillä on:
263 = 106 + n
n = 157
Kirjailija: Stefano Araújo Novais
Kemian opettaja



