reaktiot kanssa emäksiset oksidit ovat kemiallisia ilmiöitä, joissa tähän oksidiluokkaan kuuluva aine sijoitetaan samaan säiliöön kuin a epäorgaaninen happo, a hapan oksidi tai yksi amfoteerinen oksidi.
Katso myös:Reaktiot amfoteeristen oksidien kanssa
epäorgaaninen suola ja vesi ovat yleisiä tuotteita a reaktio emäksisten oksidien kanssa. Saadaksemme selville, syntyykö epäorgaanista suolaa vai vettä, meidän on tarkasteltava ainetta, joka seuraa emäksistä oksidia reagenssissa. Katso alla olevat esimerkit ja ymmärrä, kuinka tämä prosessi tapahtuu.
Reaktiot emäksisten oksidien ja epäorgaanisten happojen kanssa
Emäksisten oksidien ja epäorgaanisten happojen välisissä reaktioissa muodostuu epäorgaanista suolaa ja vettä, koska emäksinen oksidikationi (Y+) on vuorovaikutuksessa anionin kanssa (X-) hapon ja hydroniumkationin (H+) hapon vuorovaikutuksessa oksidin anionin kanssa:
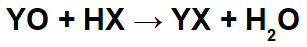
Esimerkki: Radiumoksidi ja bromivetyhappo
Tässä reaktiossa meillä on radiumoksidia (RaO) ja bromivetyhappoa (Hbr) lähtöaineina. Siten tapahtuu seuraavia vuorovaikutuksia:
Radiokationi (Ra+2) bromidianionin (Br-1) muodostaen radiumbromidisuolan (RaBr2).
Hydroniumkationi (H+1) oksidianionin kanssa (O-2) muodostaen vettä (H2O).
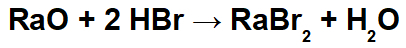
Katso myös:Reaktiot kaksoisoksidien kanssa
Reaktiot emäksisten oksidien ja happamien oksidien kanssa
Näissä reaktioissa epäorgaaninen suola muodostuu emäksisen oksidikationin (Y+) ja tuloksena oleva happoanioni (WOThe-) happaman oksidin ja veden välisestä kemiallisesta reaktiosta.
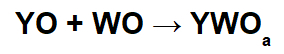
Esimerkki: Natriumoksidi ja rikkidioksidi
Tässä reaktiossa meillä on natriumoksidia (Na2O) ja rikkidioksidi (SO2). On huomionarvoista, että aluksi, kun happooksidi on vuorovaikutuksessa veden kanssa, muodostuu rikkihappoa (H2VAIN3):
Älä lopeta nyt... Mainonnan jälkeen on muutakin ;)

Tämän hapon muodostumisesta lähtien natriumkationin (Na+1) emäksisen oksidin ja sulfiittianionin (SO3-2) hapon muodostaen natriumsulfiittisuolan (Na2VAIN3):
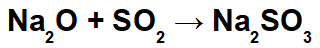
Reaktiot emäksisten oksidien ja amfoteeristen oksidien kanssa
Amfoteeriset oksidit ovat aineita, joilla on kaksi kemiallista käyttäytymistä: happaman aineen läsnä ollessa se käyttäytyy kuten emäksinen oksidi; emäksisen aineen läsnä ollessa se käyttäytyy kuin happooksidi.
Joten kun a emäksinen oksidi reagoi amfoteerisen oksidin kanssa, tämä käyttäytyy kuin happooksidi, joka muodostaa epäorgaanisen hapon veden läsnä ollessa. Epäorgaanisen hapon anionin ja emäksisen oksidin kationin välinen reaktio muodostaa suolatuotteen.
Esimerkki: Kaliumoksidi ja kromi III oksidi
Tässä reaktiossa meillä on reaktantteina kaliumoksidia (K2O) ja kromioksidi (Cr2O3). On huomionarvoista, että aluksi, kun amfoteerinen oksidi on vuorovaikutuksessa veden kanssa, muodostuu kromosomihappoa (2HCrO2):

Tämän hapon muodostumisesta lähtien kaliumkationin välinen vuorovaikutus tapahtuu (K+1) emäksisen oksidin ja kromiittianionin (SO3-2) hapon muodostaen kaliumkromiittisuolan (2KCrO2):

Kirjailija: Me. Diogo Lopes Dias
Haluatko viitata tähän tekstiin koulussa tai akateemisessa työssä? Katso:
PÄIVÄT, Diogo Lopes. "Reaktiot emäksisten oksidien kanssa"; Brasilian koulu. Saatavilla: https://brasilescola.uol.com.br/quimica/reacoes-com-oxidos-basicos.htm. Käytetty 27.7.2021.
Suolan nimikkeistö, suolaluokitus, anionin nimi, kationin nimi, rautasulfaatti, rautasulfaatti, nitraatti hopeaa, kaliumkloridia, natriumkloridia, kalsiumkloridia, hopeanitraattia, kuparisulfaattia, karbonaattia kalsiumia.


