Yksi polaarinen yhdiste (tai aine) on alue, jossa on kaksi aluetta, joilla on erilaiset elektronitiheydet. Yhdellä näistä alueista on positiivinen luonne (valkoinen alue), ja toisella on negatiivinen luonne (keltainen alue), kuten voimme nähdä seuraavasta esityksestä:

Erivaraisten alueiden esitys polaarisessa yhdisteessä
Tiedä onko tietty komposiitti on polaarinen tarkoittaa molekyylien välisen voiman tyypin tuntemista, joka suosii vuorovaikutusta sen molekyylien välillä tai niiden kanssa muiden aineiden molekyylejä sekä oletuksia niiden liukoisuudesta ja sulamispisteistä sekä kiehuvaa.
Esimerkiksi: mitä tulee liukoisuuteen, polaarisilla yhdisteillä on hyvä kyky liueta polaarisiksi yhdisteiksi. Mitä tulee molekyylien välisiin voimiin, tapauksesta riippuen polaariset yhdisteet voivat olla vuorovaikutuksessa voimien avulla pysyvät dipoli- tai vetysidokset (lujuus, joka johtaa myös korkeampiin sulamispisteisiin ja kiehuva).
Tässä on kaksi käytännön tapaa määrittää, onko yhdiste polaarinen vai ei.
Polaarisuuden määritys pilvien ja ligandien lukumäärän avulla
Voimme määrittää, jos a komposiitti on polaarinen keskusatomiin kiinnittyneiden yhtäläisten atomien lukumäärän ja kyseisessä keskusatomissa olevien elektronipilvien lukumäärän välisen suhteen perusteella.
Huomautus: Elektronipilvi on mikä tahansa kemiallinen sidos kahden atomin välillä tai atomin valenssikuoresta peräisin oleva elektronipari, joka ei osallistu sidokseen.
Jos keskusatomissa olevien pilvien määrä on eri kuin samanlaisten ligandien lukumäärä kyseisessä keskusatomissa, meillä on polaarinen yhdiste. Jotta ymmärrät paremmin, seuraa alla olevia esimerkkejä:
1. esimerkki: Syaanivetyhappomolekyyli
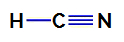
Syaanivetyhapon rakennekaava
Syaanivetyhapossa keskusatomi on hiili, jossa on neljä elektronia valenssikerros kuuluu jaksollisen järjestelmän IVA-perheeseen. Kuinka hiili muodostaa yksinkertaisen sidoksen (jakaa kaksi elektronia, yhden elektronin jokaisesta atomista mukana) vedyn kanssa ja kolmoissidos typen kanssa, joten atomissa ei ole sitoutumattomia elektroneja keskeinen.
Siten syaanivetyhapossa on kaksi elektronista pilveä (yksi sidos ja kolmoissidos) ja ligandi, joka on yhtä suuri kuin toinen. Siksi se on a polaarinen yhdiste.
2. esimerkki: Ammoniakkimolekyyli (NH3)
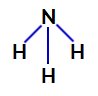
Ammoniakin rakennekaava
Ammoniakin keskusatomi on typpi, jonka valenssikuoressa on viisi elektronia, koska se kuuluu jaksollisen järjestelmän VA-perheeseen. Koska typpi muodostaa yksinkertaisen sidoksen (kaksi elektronia jakaa yhden elektronin kanssa jokainen mukana oleva atomi) kunkin vetyatomin kanssa kaksi sen viidestä elektronista ei osallistu sidoksiin.
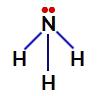
Ei-typpeä sitovia elektroneja ammoniakissa
Siten ammoniakissa on neljä elektronipilviä (kolme yksinkertaista sidosta ja sitoutumaton elektronipari) ja kolme samanlaista ligandia (kolme vetyä). Joten se on a polaarinen yhdiste.
Polaarisuuden määritys yhdisteen dipolimomenttivektorin avulla
Voimme määrittää, jos a komposiitti on polaarinen analyysin perusteella tuloksena oleva dipolimomenttivektori sen rakennekaavassa, ottaen huomioon sen molekyyligeometria ja ero elektronegatiivisuus mukana olevien atomien välillä.
Huomautus: Alkuaineiden elektronegatiivisuuden laskeva järjestys: F > O > N > Cl > Br > I > S > C > P > H.
Kun molekyylissä olevien vektorien summa on eri kuin nolla, yhdiste on polaarinen. Jotta ymmärrät paremmin, noudata seuraavia esimerkkejä:
1. esimerkki: trikloorimetaanimolekyyli
Trikloorimetaani on yhdiste, joka esiintyy tetraedrinen geometria, kuten näemme sen alla olevasta rakennekaavasta:

Trikloorimetaanin rakennekaava
Selvittääksemme, onko se polaarinen yhdiste, meidän on aluksi asetettava dipolimomenttivektorit (nuolet, jotka osoittavat, mikä atomi on stabiilimpi kuin toinen) rakenteelliseen, kuten seuraavassa esimerkissä:
Huomautus: Kloori on elektronegatiivisempi alkuaine kuin hiili. Hiili puolestaan on elektronegatiivisempi alkuaine kuin vety.
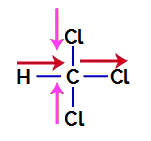
Dipolimomenttivektorit trikloorimetaanissa
Vaaleanpunaiset vektorit voidaan esittää +x: llä ja -x: llä, koska niillä on sama suunta (pystysuora) ja vastakkaiset suunnat (ylös ja alas). Punaisia vektoreita edustaa +x, koska niillä on sama suunta ja sama suunta. Näin ollen tuloksena oleva dipolimomenttivektori (vektorien summa) esitetään seuraavasti:
μr = (+x) + (-x) + (+x) + (+x)
μr = +X – x + x + x
μr = 2x
Koska tuloksena oleva dipolimomenttivektori on nollasta poikkeava, meillä on a polaarinen yhdiste.
2. esimerkki: vesimolekyyli
Vesi on yhdiste, joka esiintyy kulmageometria, kuten näemme sen alla olevasta rakennekaavasta:
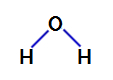
Veden rakennekaava
Selvittääksemme, onko se polaarinen yhdiste, meidän on aluksi asetettava dipolimomenttivektorit (nuolet, jotka osoittavat, mikä atomi on stabiilimpi kuin toinen) alla olevan kuvan mukaisesti:
Huomautus: Happi on elektronegatiivisempi alkuaine kuin vety.
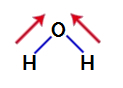
dipolimomenttivektorit vedessä
Koska veden rakenteessa olevat kaksi vektoria ovat vinottain poikki, meidän on käytettävä suuntaviivasääntöä. Tässä säännössä, kun linkitämme vektorien kannat, meillä on tuloksena olevan vektorin luominen (joka korvaa aiemmin käytetyt kaksi), kuten seuraavassa mallissa:
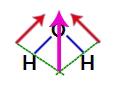
Tuloksena oleva vektori veden rakennekaavassa
Koska vesimolekyylillä on yksi vektori, tuloksena oleva dipolimomenttivektori on nollasta poikkeava, eli meillä on polaarinen yhdiste.
Kirjailija: Me. Diogo Lopes Dias
Lähde: Brasilian koulu - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-um-composto-polar.htm
