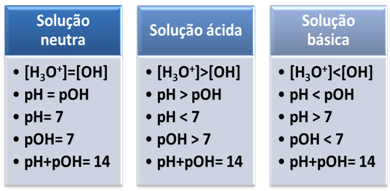
Väliainetta pidetään neutraalina, jos sen hydronium-ionien (H3O+) ja hydroksidi (OH-).
Esimerkki neutraalista väliaineesta, joka toimii jopa standardina muille liuoksille, on puhdas, tislattu vesi, jonka lämpötila on 25 ºC. Tässä lämpötilassa se on tasan 1. 10-7 mol/l molempia ioneja. Tästä syystä ioninen tuotteesi (Kw) on yhtä suuri kuin 10-14 (mol/l)2:
Kw = [H3O+]. [vai niin-]
Kw = (1. 10-7 mol/l). (1. 10-7 mol/l) = 10-14 (mol/l)2
pH ja pOH on annettu alla:
pH= - log [H3O+] pOH = -log[OH-]
pH = - log 1. 10-7 pOH= -log 1. 10-7
pH = 7pOH = 7
Tämä osoittaa meille, että neutraalissa ratkaisussa pH on yhtä suuri kuin pOH.
- Hapan väliaine:
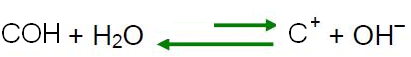
Happamassa väliaineessa H-ionien pitoisuus3O+ on suurempi kuin OH-ionien-.
Tällainen ratkaisu voidaan saada aikaan lisäämällä pieni osa H-ioneista3O+esimerkiksi hapon avulla.
Le Chatelier'n periaatteen mukaan, kun tasapainossa olevaan järjestelmään aiheutetaan häiriö, se pyrkii säätämään itsensä uudelleen vähentääkseen tämän voiman vaikutuksia. Tämä tarkoittaa, että jos veteen lisätään happoa, H-ionit
3O+ niitä on liikaa ja tasapaino siirtyy käänteiseen reaktioon, vasemmalle. Joten nämä ylimääräiset ionit reagoivat OH-ionien kanssa-. Siten OH-ionien pitoisuus- vähenee ja liuos muuttuu happamaksi.
Ionitulo (Kw) on aina 10-14, mutta H-ionien pitoisuus3O+ on suurempi kuin OH-ionien pitoisuus-1. Siksi pH on suurempi kuin pOH happamassa väliaineessa, mutta sen summa on aina 14.
Lisäksi mitä suurempi H-ionien pitoisuus3O+, sitä suurempi pH-arvo. Huoneenlämmössä (25°C), pH < 7 ja pOH > 7.

- Perus tarkoittaa:
Perusväliaineessa OH-ionien pitoisuus- on suurempi kuin H-ionien3O+.
Jos lisäämme veteen emästä, se tarkoittaa, että lisäämme OH-ioneja.- ja, kuten edellisessä kohdassa selitettiin, Le Chatelier'n periaatteella, reaktion tasapaino veden itseionisaatio liikkuu vastakkaiseen suuntaan, ja ylimääräiset ionit reagoivat H-ionit3O+, vähentää keskittymistäsi ja tekee liuoksesta emäksisen.
Siinä tapauksessa pOH on suurempi kuin pH. Huoneenlämmössä (25°C), pH > 7 ja pOH < 7.

Lyhyesti:
Kirjailija: Jennifer Fogaça
Valmistunut kemiasta