Atomimallit syntyivät tarpeesta selittää atomien rakennetta. Kun uusia todisteita atomien muodostumisesta esitettiin, uusi atomimalli yritti selventää tuloksia.
Kreikkalaiset filosofit Democritus ja Leucipo V-luvulla; Ç. jota kutsutaan atomiksi kreikan kielestä ατoμoν, aineen jakamaton hiukkanen ja pienin osa.
Vaikka atomin käsite on vanha, atomiteorioiden kehitys on peräisin 1800- ja 1900-luvuilta. Siksi tärkeimmät atomimallit, jotka kehitettiin ymmärtämään aineen luonnetta, olivat:
- Daltonin atomimalli (1803) - "Biljardipallomalli"
- Thomson Atomic Model (1898) - "Sadepuuromalli"
- Rutherfordin atomimalli (1911) - "Ydinmalli"
- Bohrin atomimalli (1913) - "planeettamalli"
- Quantum Atomic Model (1926) - "Elektroninen pilvimalli"
Daltonin atomimalli
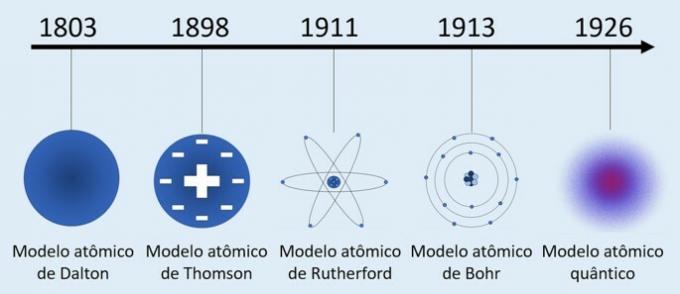
Ensimmäinen tunnustettu yritys kuvata atomeja tuli englantilaiselta tiedemieheltä John Daltonilta (1766-1844) mallilla, joka tunnettiin yleisesti nimellä "biljardipallo".
Daltonin atomi (1803): massiivinen, jakamaton ja tuhoutumaton pallo.

Daltonin mukaan:
- Kaikki aineet muodostuvat atomeista;
- Kemiallisten alkuaineiden atomit ovat kooltaan ja ominaisuuksiltaan samanlaisia, kun taas eri kemiallisten alkuaineiden atomit ovat erilaiset;
- Aineet ovat seurausta kemiallisesta reaktiosta, joka koostuu atomien rekombinaatiosta.
Negatiiviset kohdat: Koska elektroneja ei vielä ollut tiedossa, kun Dalton muotoili teoriansa, näitä hiukkasia, joiden tiedämme nyt olevan osa atomia, ei otettu huomioon.
Lisätietoja Daltonin atomimalli.
Thomson Atomic -malli
Joseph John Thomson (1856-1940) oli vastuussa elektronien, negatiivisella varauksella varustettujen ja atomien osien olemassaolon löytämisestä. Tämä löytö kumosi Daltonin atomiteorian, jonka mukaan atomi on jakamaton, mutta sen muodostavat vielä pienemmät hiukkaset, ja siksi se tunnettiin nimellä "rusinapuuro".
Thomsonin atomi (1898): positiivisesti varattu pallo, jossa kiinteät elektronit.

Thomsonin mukaan:
- Atomi on sähköisesti neutraali;
- Elektronit kiinnittyvät positiivisesti varautuneeseen pintaan;
- Atomeihin jakautuneiden elektronien välillä on vastenmielisyys.
Negatiiviset kohdat: Vaikka Thomson otti huomioon elektronien olemassaolon, atomi ei ole positiivinen pallo, vaan pikemminkin positiivisesti varautuneet hiukkaset, protonit, jotka tiedemies Eugene Goldstein tunnisti vuonna 1886 ja myöhemmin Ernest vahvisti Rutherford.
Lisätietoja Thomsonin atomimalli.
Rutherfordin atomimalli
Kokeiden avulla Ernest Rutherford (1871-1937) onnistui osoittamaan, että atomi ei ollut jakamaton partikkeli, kuten uskotaan, vaan että se muodostui pienemmistä hiukkasista.
Rutherfordin atomi (1911): positiivisesti varautunut ydin ja elektronit sijaitsevat sen ympärillä sähköpallossa.
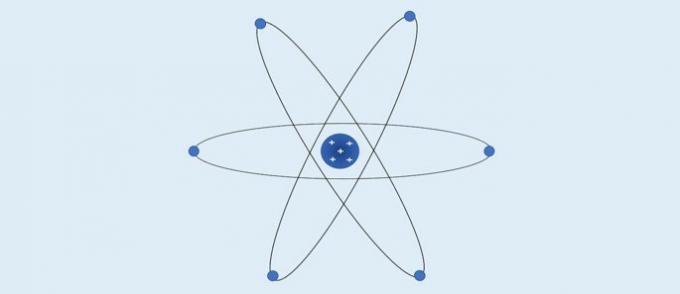
Rutherfordin mukaan:
- Atomilla on keskeinen alue, jolla on suuri positiivisen varauksen pitoisuus;
- Atomin massa on keskittynyt sen keskialueelle;
- Elektronit ovat kevyempiä ja sijaitsevat ytimen ympärillä, alueella, joka sisältää monia tyhjiä tiloja.
Negatiiviset kohdat: Atomituumassa ei ole vain positiivisesti varautuneita hiukkasia, mutta on myös muita subatomisia hiukkasia, neutronit, jotka James Chadwick löysi vuonna 1932. Lisäksi Rutherfordin ehdottama malli ei selittänyt atomien valonsäteilyä.
Lisätietoja Rutherfordin atomimalli.
Bohrin atomimalli
Pyritään selittämään, miksi elementit lähettävät tyypillisiä värejä altistuessaan joillekin olosuhteille ja Rutherfordin atomimalli Niels Bohr (1885-1962) ehdotti atomiteoriaa, joka selitti valonsäteilyä tietyissä taajuuksia.
Bohrin atomi (1913): elektronit liikkuvat kiinteissä pyöreissä kerroksissa ytimen ympärillä.
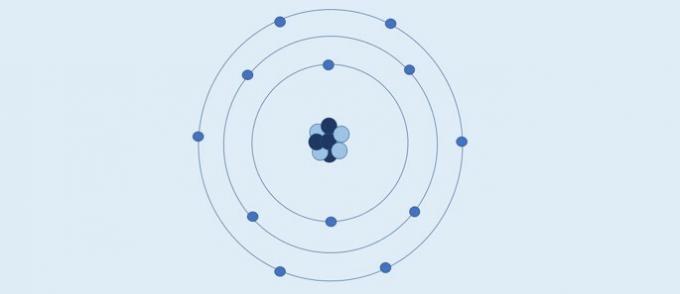
Bohrin mukaan:
- Elektronit liikkuvat ytimen ympärillä olevissa kerroksissa;
- Ytimen ympärillä olevilla kerroksilla on erityiset energia-arvot;
- Ulkopuoliselle tasolle pääsemiseksi elektronin on absorboitava energiaa. Palattuaan ydintä lähempänä olevaan kerrokseen, elektroni vapauttaa energiaa.
Negatiiviset kohdat: Ei voida sanoa, että elektronit kulkevat ytimen ympäri kiinteissä paikoissa, kuten planeetat Auringon ympäri.
Lisätietoja Bohrin atomimalli.
Kvanttiatomimalli
Monet tutkijat ovat osallistuneet kvanttimekaniikan kehittämiseen, joka yrittää selittää a: n "todellisemman" rakenteen atomi useiden tutkimusten yhdistelmällä, ja siksi se on monimutkaisin.
Kvanttiatomi (1926): ydin koostuu protoneista (positiivinen varaus) ja neutronista (nolla varaus), ja elektronit (negatiivinen varaus) muodostavat elektronisen pilven ytimen ympärille.
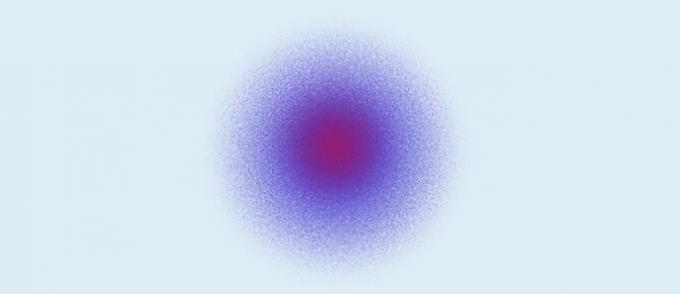
Kvanttiatomallin mukaan:
- Ydin koostuu protoneista ja neutronista. Koska vain protoneilla on varaus, ydin on positiivisesti varautunut;
- Elektronit muodostavat elektronisen pilven ytimen ympärille;
- Elektronit liikkuvat kiertoradoilla, kolmiulotteisessa tilassa;
- Elektronin tarkkaa sijaintia ei voida määrittää. Tehdään laskelmia, jotka määrittävät alueen todennäköisyyden, että elektroni on tietyssä ajassa.
Sinä kvanttiluvut tehtävänä on paikantaa elektronit. Ovatko he:
O pääkvanttiluku (n) edustaa energiatasoja eli atomin elektronisia kerroksia.
O toissijainen kvanttiluku (l) osoittaa energian alatasot, toisin sanoen energian alatasot, joihin elektroni kuuluu.
O magneettinen kvanttiluku (m) on se, joka osoittaa kiertoradan, jossa elektronit kohtaavat.
Lisätietoja atomimallit ja testaa tietosi harjoituksia atomimalleilla.

