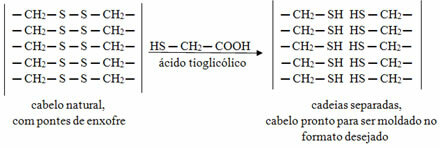
Valenssikerros on atomin elektronisen jakelun viimeinen kerros. Koska se on uloin kerros, se on myös kauimpana atomiatumasta.
Mukaan Octet-sääntö, valenssikuori tarvitsee kahdeksan elektronia stabiloitumiseen.
Siten atomit saavuttavat vakauden, kun niiden valenssikuoressa on 8 elektronia. Tämä tapahtuu jalokaasujen kanssa, niillä on täydellinen valenssikerros. Ainoa poikkeus on alkuaine Helium, jossa on 2 elektronia.
Muiden alkuaineiden on muodostettava kemialliset sidokset puuttuvien elektronien vastaanottamiseksi ja valenssikuoressa olevan kahdeksan elektronin saavuttamiseksi.
Valenssikuorielektronit osallistuvat sidoksiin, koska ne ovat kaikkein ulkoisimpia.
Sähköpallokerrokset
Rutherford-Bohrin atomimallin mukaan elektronit pyörivät atomiatumassa, eri energiakerroksissa.
Kirjaimia K, L, M, N, O, P ja Q on merkitty seitsemän kerrosta. Kukin tukee enimmäismäärää elektroneja.
 Elektroniset kerrokset ja niiden tukemat elektronimäärät
Elektroniset kerrokset ja niiden tukemat elektronimäärät
Lue myös:
- Bohrin atomimalli
- Rutherfordin atomimalli
- Jalokaasut
- Octet-sääntö
Kuinka määrittää Valencian taso?
Valenssikerros voidaan määrittää kahdella tavalla: Eletroninen jakautuminen ja Jaksollinen järjestelmä.
Valenssikerroksen määrittämiseksi sähköisen jakelun avulla Linus Pauling -kaavio.
 Pauling-kaavio
Pauling-kaavio
Muistathan, että Pauling-kaavio noudattaa kasvavaa energialuokkaa. Viimeinen elektronisessa jakelussa saatu kerros on valenssikerros.
1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10 6p6 7s2 5f14 6d10 7p6
Joten valenssikerroksessa eniten energinen alataso on viimeinen kerros.
Esimerkkejä:
Typpi - N
Atomiluku: 7
Sähköinen jakelu: 1 s2 2s2 2p3
Valencian kerros: 2s2 2p3, N: ssä on 5 elektronia valenssikuoressa.
Rauta - Fe
Atomiluku: 26
Sähköinen jakelu: 1 s2 2s2 2p6 3s2 3p6 4s2 3d6
Valencian kerros: 4s2Fe: ssä on 2 elektronia valenssikuoressa.
Kloori - Cl
Atomiluku: 17
Sähköinen jakelu: 1 s2 2s2 2p6 3s2 3p5
Valencian kerros: 3s2 3p5Cl: ssä on 7 elektronia valenssikuoressa.
Happi - O
Atomiluku: 8
Sähköinen jakelu: 1 s2 2s2 2p4
Valencian kerros: 2s2 2p4, hapessa on 6 elektronia valenssikuoressa.
Hiili - C
Atomiluku: 6
Sähköinen jakelu: 1 s2 2s2 2p2
Valencian kerros: 2s2 2p2, hiilessä on 4 elektronia valenssikuoressa.
Lue myös Kvanttinumerot.
Tähän asti käytetyt esimerkit olivat perustilassa olevien elementtien kanssa. Mutta samaa periaatetta voidaan käyttää ionit, kationit ja anionit. Katso esimerkki:
Kloridianioni - Cl-
Kloorin atomiluku on 17. Jos se olisi perustilassaan, elektronien määrä olisi yhtä suuri kuin protonien lukumäärä. Tässä tapauksessa on kuitenkin 1 elektronin vahvistus.
Tee ensin kloori-elementin sähköinen jakelu:
1s2 2s2 2p6 3s2 3p5
Lisää ylimääräisen elektronin lisäyksellä viimeiseen kerrokseen:
1s2 2s2 2p6 3s2 3p6. Joten valenssikuoressa on 8 elektronia (3s2 3p6).
Katso myös: Sähköisen jakelun harjoitukset.
Valenssikerroksen määrittämiseksi jaksollisen taulukon kautta on tarpeen tunnistaa jakso ja elementtiperhe.
Siten, kun taas 1A-perheessä on 1 valenssielektroni, 2A: ssa on 2 ja niin edelleen. Sen sisältämät kemialliset alkuaineet jaksollisten taulukoiden perhe on sama määrä elektroneja valenssikuoressa.
Tämä pätee kuitenkin vain ryhmille 1, 2, 13, 14, 15, 16 ja 17, joilla on seuraava elektronien määrä valenssikuoressa 1, 2, 3, 4, 5, 6 ja 7.
Elementeille, joissa tämä suhde ei ole mahdollista, tulisi käyttää sähköistä jakelua.
Älä unohda! Klo kemialliset sidokset syntyvät tarpeesta stabiloida atomeja ja muodostaa siten molekyylejä. Tämä tapahtuu lahjoittamalla elektroneja valenssikuoresta, joilla on taipumus luovuttaa, koska ne ovat kauempana ytimestä.
Lue myös Molekyyligeometria.
Harjoitukset
1. Etsi seuraavien elementtien valenssikerros:
Bromi
35br
1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p5
Bromin valenssikuoressa (7A-perhe) on 7 elektronia. Tämä johtuu siitä, että 4s2 ja 4p5 kuuluvat kerrokseen N, kun taas 3d10 kuuluu kerrokseen M.
Alumiini
13Al
1s2 2s2 2p6 3s2 3p1
Alumiinivalenssikuoressa (3A-perhe) on 3 elektronia.
2. (UFSC) Elektronien lukumäärä strontiumatomin kussakin alatasossa (38Sr) energian nousevassa järjestyksessä on:
a) 1 s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2
b) 1 s2 2s2 2p6 3s2 3p6 4s2 4p6 3d10 5s2
c) 1 s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 5s2
d) 1 s2 2s2 2p6 3s2 3p6 4p6 4s2 3d10 5s2
e) 1s2 2s2 2p6 3p6 3s2 4s2 4p6 3d10 5s2
a) 1 s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2
3. (IFSP / 2013) Elektronien määrä kalsiumatomin valenssikuoressa (Z = 20) perustilassa on
1: een
b) 2
c) 6
d) 8
e) 10
b) 2
Tarkista pääsykokeen kysymykset kommentoidulla resoluutiolla: Jaksollisen harjoitukset.