* Arrheniuksen teoria:
Perustuu hänen kokeisiinsa sähköjohtavuudesta vesipitoisissa väliaineissa, kemiallisesta, fysikaalisesta ja matemaattisesta Ruotsalainen Svante August Arrhenius (1859-1927) ehdotti vuonna 1884 seuraavia käsitteitä happojen ja perustaa:

Joten meillä on yleisesti:
H+ + H2O → H3O+
Esimerkkejä:
HCl + H2O → H3O++ Cl-
HNO3+ H2O → H3O+ + EI3-
H2VAIN4+ 2H2O → 2H3O+ + Käyttöjärjestelmä42-

Esimerkkejä:
NaOH → Na + + OH-
Ca (OH)2 → Ca2+ + 2 OH-
* Brönsted-Lowry-teoria:
Itsenäisesti tanskalainen Johannes Nicolaus Brönsted (1879-1947) ja englantilainen Thomas Martin Lowry (1874-1936), ehdotti samana vuonna toista happo-emästeoriaa, joka tunnetaan nimellä Brönsted-Lowry Theory, joka sanoo Seurata:

Tässä tapauksessa vetyionia pidetään protonina. Tämä näkyy seuraavassa reaktiossa, jossa syaanivetyhappo luovuttaa protonin vedelle, joka toimii siten emäksenä:
HCN + H2O → CN- + H3O+
Tämä reaktio on palautuva hydroniumionin (H3O+) voi lahjoittaa protonin CN-ionille-. Siten hydroniumioni (H3O+) toimii happona ja CN- perustana.
CN- + H3O+→ HCN + H2O
* Lewisin teoria:
Tämän teorian loi amerikkalainen kemisti Gilbert Newton Lewis (1875-1946), ja se sanoo seuraavaa:

Tämä teoria esittelee uuden käsitteen, on kattavampi, mutta ei mitätöi Brönsted-Lowry -teoriaa. Jokainen Lewis-happo on Brönsted-happo, ja siksi jokainen Lewis-emäs on Brönsted-emäs. Tämä johtuu siitä, että protoni vastaanottaa elektroneja, mikä tarkoittaa, että Lewis-happo voi liittyä yksinäiseen elektronipariin Lewis-emäksessä.
Lewisin tapauksessa happo-emäs-reaktio koostuu vakaamman koordinoidun kovalenttisen sidoksen muodostumisesta. Joten kun Lewis-emäs lahjoittaa elektroniparin Lewis-emäkselle, molemmat muodostavat a koordinaattikovalenttinen sidos, jossa molemmat elektronit tulevat yhdestä atomista, kuten esimerkissä karjua:
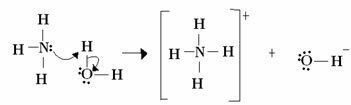
Tässä tapauksessa ammoniakki toimii Lewisin ja Brönstedin emäksenä, koska se luovuttaa kaksi elektroniaan protonille ja on siten protonin vastaanottaja. Lisäksi muodostui kovalenttinen sidos vedyn (protoni) ja ammoniakin välille.
Vesi on Lewis-happo ja Brönsted-happo, kun se luovuttaa protonia ja vastaanottaa elektroneja, huomaa, kuinka vedestä muodostuvan hydroksidin hapessa on ylimääräinen elektronipari.

Kirjailija: Jennifer Fogaça
Valmistunut kemian alalta
Brasilian koulutiimi.
Lähde: Brasilian koulu - https://brasilescola.uol.com.br/quimica/teorias-acidobase-arrheniusbronstedlowry-lewis.htm
