Termodynamiikan kolmas laki käsittelee aineen käyttäytymistä entropian lähestyessä nollaa.
Tämän lain mukaan aina kun järjestelmä on termodynaamisessa tasapainossa, sen entropia lähestyy nollaa.
Termodynamiikan toinen laki liittyy entropiaan. Myöhemmin kolmas laki näkyy a yritä luoda absoluuttinen vertailupiste, joka määrittää entropian.
Walther Nernst (1864-1941) oli fyysikko, joka käsitteli periaatteita, jotka muodostivat perustan kolmannelle termodynamiikan laille.
Nernstin mukaan entropialla olisi taipumus olla vähimmäisarvo, jos puhtaan aineen lämpötila olisi yhtä suuri tai lähestyisi absoluuttista nollaa.
Tätä varten Nernst ehdotti alla olevaa kaavaa, joka osoittaa, että entropian (ΔS) ja lämpötilan (T) vaihtelu pyrkii minimiarvoihin, ts. 0:
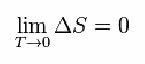
Mutta mikä on Entropia?
Haje se on tapa, jolla molekyylit organisoituvat järjestelmään. Tämä organisaatio tarkoittaa häiriötä, ei sekaannuksen, vaan molekyylien liikkumisen ja levottomuuden merkityksessä.
Mitä enemmän molekyylejä voi liikkua, sitä epäjärjestyneemmät ne ovat, sitä enemmän entropia heillä on.
Aluksi Nernst ehdotti, että hänen ehdottama entropia olisi mahdollinen vain täydellisillä kiteillä.
Lopuksi hän totesi, että absoluuttisen nollan lämpötilaa ei ollut olemassa, mikä tekee kolmannesta laista kiistanalaisen lain.
Joten monille fyysikoille tämä ei ole laki vaan sääntö.
Niin monen vuoden (vuodesta 1912) jälkeen tutkijat yrittävät saada tämän lämpötilan tai lämpötilat, jotka tulevat lähemmäksi ja lähemmäksi absoluuttista nollaa. Niinpä he huomasivat, että se on mahdollista vain kaasuissa, heittämällä pois kaikki kiinteässä tai nestemäisessä tilassa olevat aineet.
Lue myös:
- Termodynamiikan nolla laki
- Ensimmäinen termodynamiikan laki
- Toinen termodynamiikan laki
- Harjoituksia termodynamiikasta


