Kuten selitettiin tekstissäKatalyysi ja katalyytti”, Katalyytit ovat kemiallisia lajeja, jotka nopeuttavat reaktioiden nopeutta. Sen käyttö on erittäin hyödyllistä kemianteollisuudessa, jossa tuotannossa pyritään säästämään mahdollisimman paljon aikaa.
Tietyissä tilanteissa on kuitenkin mielenkiintoisempaa, että reaktio etenee hitaammin; kuten esimerkiksi kun haluat määrittää erittäin nopeiden reaktioiden nopeuden. Tämän saavutuksen saavuttamiseksi, kontrolloimalla ja tutkimalla näitä reaktioita, on tavallista lisätä ainetta, joka hidastaa reaktioita, joita kutsutaan estäjät, myrkyt tai katalysaattorit.
Nämä kemialliset lajit yhdistyvät katalysaattoriin, mikä mitätöi tai heikentää sen vaikutusta. Tämä on mahdollista, koska katalyytin toimintamekanismi on vähentää aktivaatioenergiaa, helpottaa reaktioprosessia ja lisätä sen nopeutta; jo estäjät toimivat käänteisesti, mikä tarkoittaa, että ne lisäävät aktivointienergiaa, joka tarvitaan reaktanttien pääsemiseksi aktivoituneeseen kompleksiin.
Esimerkkinä voidaan mainita arseeni (As), jolla on tämä tehtävä Haber-Bosch-reaktiossa, reaktiossa, jota käytetään teollisuudessa laajalti ammoniakin valmistuksessa rautaa (Fes) katalysaattorina. Siten raudan hyötysuhde muuttuu hyvin pieneksi arseenin läsnä ollessa, mikä estää sitä, eli se on tämän reaktion katalyyttimyrkky, joka on esitetty alla:
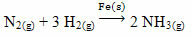
Arseeni voi myös vaikuttaa anti-katalyyttisesti, kun käytetään metallista platinaa (Pts) katalysaattorina SO-palamisreaktiossa2 g), rikkitrioksidin (SO3 g)). Arseenin läsnäolo, jopa pieninä määrinä, poistaa platinan katalyyttisen vaikutuksen, mikä voi lamauttaa osan tuotannosta. Siksi teollisuudessa, jotka käsittelevät tätä tuotantoa, käytetään yleensä divanadiumpentoksidia (V2O5 (s)) katalysaattorina platinan sijasta.
Älä lopeta nyt... Mainonnan jälkeen on enemmän;)
Toinen esimerkki tapahtuu seuraavassa vetyperoksidin hajoamisreaktiossa:
2 tuntia2O2 (aq) → 2 H2O(1) + 1 O2 g)
Tässä tapauksessa estäjä, jota voidaan käyttää, on jonkin verran happoa, koska kun väliaine on hapan, reaktio etenee hitaammin.
Mutta teollisuus käyttää myös inhibiittoria laajalti pääasiassa elintarvikkeiden, juomien, kosmetiikan ja lääkkeiden luonnollisen hajoamisen reaktion hidastimena.
Esimerkiksi kosmetiikka voi kestää kauan saavuttaa kuluttajan; siten niissä käytetään erilaisia säilöntäaineita, kuten propyyliparabeenia, jota käytetään öljyfaasissa ja joka toimii sienilääkkeenä, ja metyyliparabeenia, jota käytetään vesifaasissa ja jolla on antiseptinen vaikutus. Niiden rakenteet on esitetty alla:
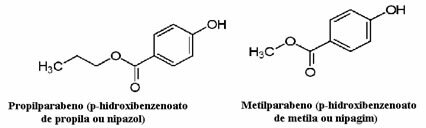
On mielenkiintoista, että monissa kosmeettisissa etiketeissä on seuraava lause: "Se ei sisällä parabeeneja". Tämä tarkoittaa, että tässä kosmeettisessa valmisteessa ei ole mainittuja säilöntäaineita ja että normaalisti niitä ei ole testattu eläimillä.
Kirjailija: Jennifer Fogaça
Valmistunut kemian alalta
Haluatko viitata tähän tekstiin koulussa tai akateemisessa työssä? Katso:
FOGAÇA, Jennifer Rocha Vargas. "Katalysaattorin estäjät"; Brasilian koulu. Saatavilla: https://brasilescola.uol.com.br/quimica/inibidores-catalisador.htm. Pääsy 27. kesäkuuta 2021.