Isomeria se on luonnollinen ilmiö, jossa eri aineilla (kemiallisten ja fysikaalisten ominaisuuksien suhteen) on täsmälleen sama molekyylikaava kuin seuraavassa esimerkissä:
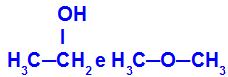
Eri aineet, joilla on sama molekyylikaava
Etanolilla (vasemmalla) on molekyylikaava C2H6O, jota esiintyy myös metoksietaanin kanssa (oikealla), joten ne ovat isomeerejä.
Isomerismin tyypit
→ tasainen isomeeri
Isomeerityyppi tutkii isomeerien rakenteellisia eroja.
) Ammatti
Se on litteän isomerismin tyyppi, jossa aineiden välinen ero perustuu niiden orgaanisten toimintojen väliseen eroon, joihin ne kuuluvat. Katso joitain esimerkkejä:
Propanoni ja propaani:
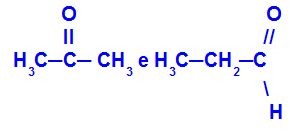
Eri toimintoihin kuuluvat isomeerit
Propanoni (vasen) kuuluu ketoniryhmään ja propanaali (oikea) aldehydiryhmään.
B) Vankila
Se on litteän isomerismin tyyppi, jossa aineiden välinen ero perustuu niiden sisältämien ketjujen eroon. Katso esimerkki:
2-metyylipropaani ja butaani
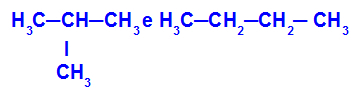
Isomeerit, joilla on ketjut eri luokituksilla
Esimerkissä voimme nähdä, että 2-metyylipropaanilla (vasemmalla) on haarautunut ketju ja butaanilla (oikealla) on normaali ketju.
ç) Sijainti
Se on litteän isomerismin tyyppi, jossa aineiden välinen ero perustuu niiden ketjuissa läsnä olevan komponentin sijaintieroon. Katso esimerkki:
1-klooripropaani ja 2-klooripropaani
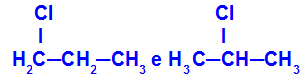
Isomeerit, joilla on komponentteja ketjun eri kohdissa
Esimerkissä voimme nähdä, että 1-klooripropaanilla (vasemmalla) kloori on hiilessä 1 ja 2-klooripropaanilla (oikealla) kloori on hiilellä 2.
d) Metameria tai korvaus
MERKINTÄ: Isomerismi pätee yksinomaan heterogeenisiin jousiin.
Se on litteän isomerismin tyyppi, jossa aineiden välinen ero perustuu niiden ketjuissa olevan heteroatomin sijaintieroon. Katso esimerkki:
Esimerkki: Metoksipropaani ja etoksietaani
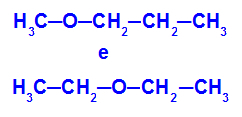
Isomeerit, joilla on heteroatomeja ketjun eri kohdissa
Esimerkissä voimme nähdä, että metoksipropaanissa (vasemmalla) hapella on radikaali, jonka toisella puolella on yksi hiili ja toisella puolella kolme hiiltä. Etoksietaanissa (oikealla) hapessa on radikaali, jossa on kaksi hiiltä toisella puolella ja kaksi hiiltä toisella puolella.
ja)Tautomery
Se on erityinen tasofunktio-isomerismi ja sitä esiintyy vain kolmessa orgaanisessa toiminnossa:
Aldehydi
ketoni
Enol
Tämän tyyppinen isomerismi vaikuttaa siihen, että enolin ja aldehydin sekä enolin ja ketonin välillä on kemiallinen tasapaino, eli nämä komponentit muuttuvat jatkuvasti toisilleen. Katso esimerkki:
Prop-2-en-1-oli ja propanoni
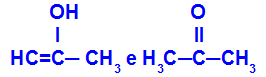
Eri toimintoihin kuuluvat isomeerit
Esimerkissä voimme nähdä, että Prop-2-en-1-oli (vasemmalla) kuuluu enolien ryhmään ja propanoni (oikealla) ketonien ryhmään, joten ne ovat tautomeerian isomeerejä.
→ Avaruuden isomeria
Se on eräänlainen isomerismi, joka määritetään molekyylin spatiaalisen analyysin avulla.
a) Geometriset isomeerit
Älä lopeta nyt... Mainonnan jälkeen on enemmän;)
Se on eräänlainen spatiaalinen isomeria, joka tapahtuu, kun aineella on molekyylejä, joilla on seuraavat ominaisuudet:
Suljettu ketju, jossa on kaksi hiiltä ja kaksi erilaista ligandia, kuten alla olevassa esimerkissä:

Suljettu rakenne, jossa on geometrinen isomerismi
Avoin ketju, jolla on kaksoissidos hiilien välillä, ja kussakin näistä kaksoissidoksen hiileistä on kaksi erilaista ligandia, kuten alla olevassa esimerkissä:
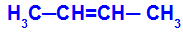
Avoin rakenne, jossa on geometrinen isomerismi
Geometrinen isomeria on jaettu kahteen ryhmään:
1O Ryhmä: cis-trans
Se tapahtuu, kun yhden hiilen kaksi ligandia ovat tiukasti yhtä suuret kuin toisen hiilen kaksi ligandia, joko avoimessa tai suljetussa rakenteessa.
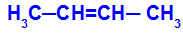
Aineen ketju, jolla on cis-trans-isomeeria
Isomeeriä kutsutaan cisiksi, kun samat ligandit ovat samassa tasossa.

Esimerkki cis-isomeeristä
Isomeeriä kutsutaan transiksi, kun eri ligandit ovat samassa tasossa.

Esimerkki trans-isomeeristä
2O Ryhmä: E-Z
Se tapahtuu, kun yhden hiilen kaksi ligandia ovat erilaiset toisen hiilen kahden ligandin suhteen joko avoimessa tai suljetussa rakenteessa.

Ketjun aine, jolla on E-Z-isomerismia
Isomeeriä kutsutaan E: ksi, kun suurimman atomimäärän omaavat ligandit ovat vastakkaisissa tasoissa. Alla olevassa esimerkissä vasemmalla olevalla hiilellä on korkeimman atomiluvun Br (35) ja toisessa on happi (8).
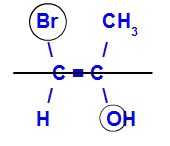
Esimerkki E-isomeeristä
Isomeeriä kutsutaan Z: ksi, kun ligandit, joilla on suurin atomiluku, ovat samalla tasolla. Alla olevassa esimerkissä vasemmalla olevalla hiilellä on korkeimman atomiluvun Br (35) ja toisessa on happi (8).

Esimerkki Z-isomeeristä
B) optinen isomeeri
Se on eräänlainen spatiaalinen isomerismi, jota esiintyy vain, jos aineella on molekyylejä kiraalinen hiili (jolla on neljä erilaista ligandia) rakenteissaan. Kiraalisen hiilen sisältävällä molekyylillä on kyky polarisoida ja taipua valoa seuraavasti:
Oikealle (oikea isomeeri)
Vasemmalle (kääntyvä isomeeri)
Yhdisteellä, jolla on optinen aktiivisuus, on aina aktiiviset isomeerit (kutsutaan optisiksi antipodeiksi) ja inaktiiviset isomeerit (seos kahden aktiivisen isomeerin välillä, seos, jota kutsutaan raseemiseksi).
Voimme käyttää seuraavaa kaavaa kiraalista hiiltä sisältävän yhdisteen aktiivisten (IOA) ja inaktiivisten (IOI) isomeerien määrän määrittämiseksi:
IOA = 2ei
IOI = 2ei
2
Alla on esimerkki yhdisteestä, jolla on geometrinen isomerismi:
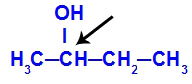
Kiraalihiili esillä butan-2-olissa
Butan-2-olin rakenteessa on seuraavat ligandit:
Metyyli (CH3)
Etyyli (CH3-CH2)
Vety (H)
Hydroksyyli (OH)
Koska siinä on vain yksi kiraalinen hiili, butan-2-oli: lla on:
Aktiiviset isomeerit:
IOA = 21
IOA = 2
Passiiviset isomeerit:
IOI = 21
2
IOI = 2
2
IOI = 1
Minun luona. Diogo Lopes Dias
Haluatko viitata tähän tekstiin koulussa tai akateemisessa työssä? Katso:
PÄIVÄT, Diogo Lopes. "Mikä on isomerismi?"; Brasilian koulu. Saatavilla: https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-isomeria.htm. Pääsy 27. kesäkuuta 2021.