Sillä luokitella sigmalinkki, on välttämätöntä osata tunnistaa se molekyylin rakenteessa. Sigmasidos on itse asiassa kovalenttinen sidos tapahtuu, kun kaksi epätäydellistä atomirataista (vain yhdellä elektronilla) tunkeutua samalla akselilla. Esimerkki on, kun p-tyyppinen (kierukka) kiertorata tunkeutuu toisen p-kiertoradan kanssa.

p-orbitaalit, jotka tunkeutuvat p-p-sigmasidokseen
Käytännössä (harjoituksissa), sigmalinkin tunnistaminen ja luokittelu tehdään rakennekaavasta aineen, kuten alla olevassa rakenteellisessa esityksessä:

Syaanivetyhapon rakennekaava
Ennen kuin luokitat sigmalinkin, on tarpeen osata tunnistaa se rakennekaavassa. Tätä varten muista vain tapoja, kuten a kovalenttisidos on edustettuna: Soitto yksinkertainen on yksi viiva (-), pari on kaksi (=) ja linkki kolminkertaistaa on kolme (≡). Sigmasidos on läsnä missä tahansa kolmesta kovalenttisten sidosten esityksestä seuraavasti:
Yksinkertainen: on sigmasidos;
Pari: Kahden linkin joukosta vain yksi on sigma;
Kolminkertaistaa: Yksi kolmesta linkistä on sigma.
Seuraava askel on oppia tunnistamaan sigmalinkki, kuinka se luokitellaan. Tätä varten meidän on tiedettävä, mikä on jokaisen sidokseen liittyvän atomin epätäydellinen kiertorata:
H - esittää epätäydellisen orbitaalin, joten luokittelussa sitä edustaa s.
Ametals- joilla on epätäydellinen p-orbitaali, joten luokituksessa niitä edustaa p, lukuun ottamatta seuraavia elementtejä:
Hiili: Keskeneräinen kiertoratasi riippuu tyypistä hybridisaatio että hän kärsii. Mahdollisuudet ovat: sp hybridisaatio3 (kuinka paljon se soittaa neljä yksinkertaista puhelua), sp2 (kuinka paljon se tekee kaksi yksittäistä ja yhtä kaksoissidosta) tai sp (kuinka paljon se suorittaa kaksi kaksoissidosta tai yhden ja yhden kolmoissidoksen). Siten sigmasidoksen luokituksessa hiili voidaan esittää sp3, sp2 tai sp riippuen soitettavasta puhelusta.
Beryllium:kärsivät sp-tyypin hybridisaatio, siis luokittelussa sitä edustaa sp.
Boori:kärsivät sp-tyypin hybridisaatio2, joten luokituksessa sitä edustaa sp.2.
Kaikilla näillä tiedoilla helpoin osa on luokitella rakenteessa olevat sigmalinkit. Katsotaanpa joitain esimerkkejä:
Esimerkki 1: sigma-liitännät vedessä

Veden rakennekaava
Älä lopeta nyt... Mainonnan jälkeen on enemmän;)
Yllä oleva rakennekaava osoittaa, että vedellä on kaksi sigmasidosta (kaksi yksinkertaista), he ovat hapen välillä (jota edustaa s) se on Vety (edustaa s). Siksi meillä on kaksi sigmalinkkiä, jotka on luokiteltu:
s-s
Esimerkki 2: Sigma sitoutuu fosforitrikloridiin

Fosforitrikloridin rakennekaava
Yllä oleva rakennekaava osoittaa, että fosforitrikloridilla on kolme puheluasigmat (kolme yksinkertaista) anna fosfori (jota edustaa s) se on kloori (jota edustaa s). Siten meillä on kolme sigmalinkkiä, jotka on luokiteltu:
p-p
Esimerkki 3: sigmasidokset booritrifluoridissa
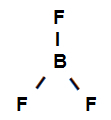
Booritrifluoridin rakennekaava
Yllä oleva rakennekaava osoittaa, että booritrifluoridilla on kolme sigmalinkkiä (kolme yksinkertaista) anna boori (edustaa sp2) se on Fluori (jota edustaa s). Siten meillä on kolme sigmalinkkiä, jotka on luokiteltu:
p-sp2
Esimerkki 4: sigma-sidokset etanolissa
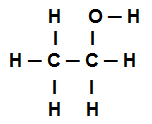
Etanolin rakennekaava
Edellä oleva etanolin rakennekaava osoittaa sen meillä on läsnä kahdeksan puhelua sigmat (kahdeksan yksinkertaista linkkiä). Ovatko he:
Yksi hapen joukosta (edustaa p) ja vety (edustaa s). Siten linkki luokitellaan sigmaksi s-p.
Yksi kahdesta hiilestä jotka suorittavat vain sigmakytkennät (ja sitten edustaa sp3). Siten linkki luokitellaan sp3-P3.
Yksi hiilen joukosta (edustaa sp3) ja happea (jota edustaa s). Siten sigmalinkki luokitellaan p-sp3.
viisi hiilen välillä (edustaa sp3) ja vety (edustaa s). Siten kaikki viisi luokitellaan s-sp3.
Esimerkki 5: Sigma sitoutuu dikloorieteeniin

Dikloorieteenin rakennekaava
Edellä oleva dikloorieteenin rakennekaava osoittaa, että meillä on viisi sigmalinkkiä (neljä yksittäistä joukkolainaa ja yksi kaksoissidoksista). Ovatko he:
Yksi kahdesta hiilestä jotka suorittavat kaksi yksittäistä ja yhtä kaksoissidosta (ja sitten edustaa sp2). Siten sigmalinkki luokitellaan sp2-P2.
Neljä on hiilen välillä(edustaja sp2)ja vety (edustaa s). Siten kaikki neljä luokitellaan s-sp2.
Minun luona. Diogo Lopes Dias
Haluatko viitata tähän tekstiin koulussa tai akateemisessa työssä? Katso:
PÄIVÄT, Diogo Lopes. "Sigma-linkin luokitus"; Brasilian koulu. Saatavilla: https://brasilescola.uol.com.br/quimica/classificacao-uma-ligacao-sigma.htm. Pääsy 28. kesäkuuta 2021.