
Joskus se voi tapahtua vähimmäiskaava olla sama kuin yhdisteen molekyylikaava; tämä ei kuitenkaan aina ole totta.
Esimerkiksi empiirinen tai minimaalinen kaava vedelle on H2O, mikä osoittaa, että vesimolekyylien muodostavien elementtien välillä on 2: 1-suhde. Ja sattumalta tämä on myös veden molekyylikaava. Katso kuitenkin kahta alla olevaa esimerkkiä, jotta näin ei aina käy:
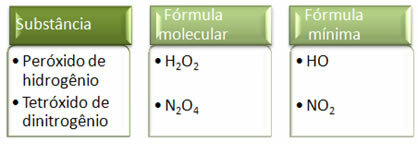
Koska vähimmäiskaava on vain kunkin elementin atomien suhde eikä niiden todellinen määrä molekyylikaavassa, se voi tapahtua Eri yhdisteitä, joilla on sama empiirinen kaava ja jopa yhdisteen vähimmäiskaava, voivat olla samat kuin molekyylin kaavan muut. Huomaa, miten tämä voi tapahtua alla olevassa esimerkissä:
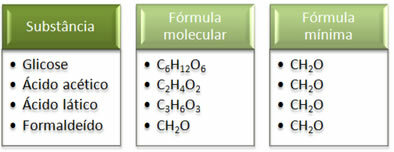
Katso, että vähimmäiskaava CH2Se on sama kaikille aineille, eli tämä vähimmäiskaava ilmaisee, että kaikissa tapauksissa hiili-, vety- ja happiatomeja on molekyylikaavoissa suhteessa 1:2:1. Lisäksi ainoa, jolla on sama molekyylikaava kuin empiirisellä kaavalla, on formaldehydi.
- Pienimmän tai empiirisen kaavan laskeminen:
Yhdisteen empiirisen kaavan määrittämiseksi on ensin tiedettävä, mikä on sen prosenttiosuus tai läheinen kaava. Tämä voidaan tehdä mittaamalla kunkin elementin massa 100 g: ssa näytettä. Teksti "Prosentti- tai sentesimaalinen kaava”Selventää tätä asiaa paremmin.
Älä lopeta nyt... Mainonnan jälkeen on enemmän;)
Oletetaan esimerkiksi, että tietyn yhdisteen läheisen koostumuksen antaa: 40,00% C, 6,67% H ja 53,33% O. Annamme nämä arvot grammoiksi, kun otetaan huomioon 100 g yhdistenäytteen massa. Siten meillä on: 40 g C: tä, 6,67 g H ja 53,33 g O.
Nyt on tarpeen siirtää nämä arvot aineen määrälle (mol). Teemme tämän jakamalla kukin löydetyistä arvoista vastaavilla moolimassoilla:
C: 40/12 = 3,33
H: 6,67 / 1 = 6,67
O: 53,33 / 16 = 3,33
Koska arvot eivät ole kokonaislukuja, käytämme seuraavaa laitetta: jaamme kaikki arvot pienimmällä, jotta niiden välinen suhde ei muutu.
Tässä tapauksessa pienin arvo on 3,33, joten tulos on:
C: 3,33 / 3,33 = 1
H: 6,67 / 3,33 = 2
O: 3,33 / 3,33 = 1
Siksi tämän tuntemattoman aineen vähimmäiskaava on yhtä suuri kuin: Ç1H2O1 tai CH2O.
Lyhyesti sanottuna aineen empiirisen tai minimaalisen kaavan löytämiseksi tarvittavat vaiheet ovat:

Kirjailija: Jennifer Fogaça
Valmistunut kemian alalta
Haluatko viitata tähän tekstiin koulussa tai akateemisessa työssä? Katso:
FOGAÇA, Jennifer Rocha Vargas. "Minimi- tai empiirinen kaava"; Brasilian koulu. Saatavilla: https://brasilescola.uol.com.br/quimica/formula-minima-ou-empirica.htm. Pääsy 28. kesäkuuta 2021.


