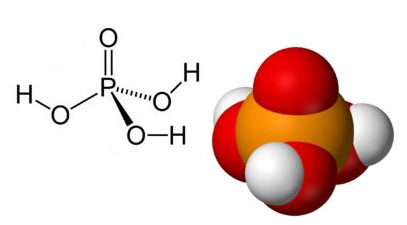
Sulfaatit ovat ionisia yhdisteitä, jotka sisältävät anionia SO42-, jota kutsutaan sulfaattianioniksi.
Rikki on osa 16- tai VI-A-perhettä, mikä tarkoittaa, että sen valenssikuoressa on 6 elektronia. Oktetisäännön mukaan sen on vastaanotettava vielä 2 elektronia, jotta viimeisessä elektronikuoressa olisi 8 elektronia ja siten stabiili. Rikki kuitenkin laajenee oktetilla, koska se on elementti, joka sijaitsee taulukon kolmannella jaksolla Säännöllinen, suhteellisen suuri, mikä sallii sen sijoittaa yli kahdeksan elektronia noin.
Siten, kuten alla voidaan nähdä, rikkin valenssitaso laajenee siten, että siinä on yhteensä 12 elektronia. Mutta kaksi happiatomia eivät vieläkään ole stabiileja, joista jokaisella on seitsemän elektronia valenssikuoressa, joten niiden on saatava yksi elektroni lisää vakautumiseksi. Tästä syystä näiden kahden atomin varaus on -1, mikä johtaa anionin kokonaisvaraukseen -2:

Sulfaattianioni voi tulla rikkihaposta (H2VAIN4 (aq)) nähtävissä alapuolella:

Rikkihappo reagoi jonkin emäksen kanssa neutralointireaktiossa muodostaen epäorgaanisen suolan, joka on sulfaattimme, ja myös veden:
Yleinen reaktio: Rikkihappo + emäs → Suola (sulfaatti) + vesi
H2VAIN4 + 2 Çvai niin →Ç2VAIN4+ 2 H2O
Katso alla oleva esimerkki, jossa muodostuu kaliumsulfaattia:
H2VAIN4 + 2 KOH →K2VAIN4+ 2 H2O
Huomaa, että sulfaatin nimikkeistö tehdään yksinkertaisesti säännön mukaan: sulfaatti + siihen liitetyn elementin nimi. Lisäksi sulfaattien kaavat tehdään vaihtamalla kunkin ionin varaus elementti-indeksiin, eikä indeksiä "1" tarvitse kirjoittaa:
Esimerkkejä:
Klo+1 VAIN42- → Klo2VAIN4→ natriumsulfaatti
mg+2 VAIN42- → MgSO44→ magnesium sulfaatti
Tässä+2 VAIN42- → Asia4→ kalsiumsulfaatti
Ba+2 VAIN42- → BASO4→ bariumsulfaatti
Al+3 VAIN42- → Al2(VAIN4)3→ alumiinisulfaatti
Älä lopeta nyt... Mainonnan jälkeen on enemmän;)
Sulfaatti-ionia sisältävät suolat ovat yleensä vesiliukoisia, lukuun ottamatta neljää: kalsiumsulfaatti (CaSO4), strontiumsulfaatti (SrSO4), bariumsulfaatti (BaSO4) ja lyijysulfaatti (PbSO4). Tämä johtuu siitä, että näiden kationien välillä on suuri sitoutumisenergia (Ca2+, hyvä herra2+, Ba2+ ja Pb2+) ja sulfaatti, koska niillä kaikilla on +2 varaus ja sulfaattianionilla on -2 varaus. Siten yhteyden katkaiseminen tulee vaikeammaksi.
Sulfaatteja esiintyy kiteisten hilojen muodossa johtuen vetovoimasta, jota vastakkaiset varaukset kohdistavat toisiinsa, kuten alla on esitetty kuparisulfaatin tapauksessa (CuSO4):

Sulfaatteja esiintyy luonnossa pääasiassa mineraalien muodossa. Katso joitain esimerkkejä:
bariitti → bariumsulfaatti;
Kipsi → kalsiumsulfaatti;
Selestiitti → strontiumsulfaatti;
kulmatOK → lyijysulfaatti;
Glauberiitti → kaksinkertainen kalsium- ja natriumsulfaatti: CaNa2(VAIN4)2;
Kaliumaluna (kaliniitti) → hydratoitu kaksinkertainen kaliumalumiinisulfaatti: KAl (SO4) 2,11H2O
Jokapäiväisen elämän tärkeimpien sulfaattien joukossa meillä on kalsiumsulfaattia, jota vedettömässä muodossa (ilman vettä) käytetään koululiidun valmistuksessa. Kun se on dihydraattimuodossa, (CaSO4 .2h2O), se tunnetaan kipsiä ja sitä on enemmän. Kuumennettaessa se muodostaa kalsiumsulfaattihemihydraatin (CaSO4. ½H2O), joka on kipsi, jota käytetään ortopediassa, hammasmuotissa, siviilirakentamisessa ja maaleissa.

Toinen tärkeä suola on smagnesiumsulfaatti (MgSO44), tunnetaan nimellä skatkera al- tai Epsom-suola, jolla on laksatiivinen vaikutus ja jota käytetään hierontaan ja rentouttaviin kylpyihin.

Kirjailija: Jennifer Fogaça
Valmistunut kemian alalta
Haluatko viitata tähän tekstiin koulussa tai akateemisessa työssä? Katso:
FOGAÇA, Jennifer Rocha Vargas. "Sulfaatit"; Brasilian koulu. Saatavilla: https://brasilescola.uol.com.br/quimica/sulfatos.htm. Pääsy 28. kesäkuuta 2021.