Joseph Lous Gay-Lussac (1778-1850) oli tutkija, joka teki tärkeitä kaasututkimuksia. Hän suoritti veden tuotannon vety- ja happikaasujen välisessä reaktiossa ja vahvisti, että ne ovat reagoivat aina kahden vety- ja yhden happitilavuuden suhteessa, tuottaen kaksi tilavuutta vetyä Vesi:
Vety + happi → vesi
1. koe: 2 L 1 L 2 L
2. koe: 4 L 2 L 4 L
3. koe: 8 L 4 L 8 L
4. koe: 16 L 8 L 160 L
Huomaa, että kaikissa kokeissa suhde on aina sama: 2: 1: 2.
Useiden kokeiden ja analyysien jälkeen huomaten, että sama tapahtui muun tyyppisissä reaktioissa kaasujen välillä, toisin sanoen reaktioissa seurasi aina vakio-tilavuussuhdetta, tämä tutkija pääsi seuraavaan kaasumaisissa reaktioissa esiintyvään lakiin, joka tunnetaan nimellä Gay-Lussac-mittarilaki tai Volyymien yhdistämisen laki:

Lausunto Gay-Lussacin tilavuuslaista
Mutta tämä laki oli Daltonin atomiteoria, joka sanoi, että kaiken muodostivat massiiviset ja jakamattomat pallomaiset hiukkaset, atomit. Tämän teorian mukaan tuotteiden määrän reaktiossa tulisi olla yhtä suuri kuin reagoivien aineiden tilavuuksien summa. Siksi seuraavien pitäisi tapahtua:
Vety + happi → vesi
2 osaa + 1 tilavuus → 3 tilavuutta
Mutta Gay-Lussac osoitti, ettei näin ollut käytännössä, tulos oli yhtä suuri kuin kaksi vesihöyryn tilavuutta.
Älä lopeta nyt... Mainonnan jälkeen on enemmän;)
Vastaus tähän ilmeiseen ristiriitaan tuli hypoteesi tai Avogadron laki.

Italiassa painetussa postimerkissä näkyy Amedeo Avogadro ja hänen lainsa vuonna 1956 *
Amedeo Avogadro (1776-1856) osoittivat, että todellisuudessa kaasut eivät olleet eristettyjä atomeja, vaan molekyylejä (lukuun ottamatta jalokaasut). Hänen laissaan sanottiin:

Avogadron lakilausuma
Avogadro osoitti sen 1 mooli kaikesta kaasusta on 6,02. 1023 molekyylejä. Tämä arvo tunnetaan nimellä Avogadron numero tai vakio. Todettiin, että normaaleissa lämpötila- ja paineolosuhteissa (CNTP), joissa paine on yhtä suuri kuin 1 atm ja lämpötila on 273 K (0 ° C), 1 moolin kaasun käyttämä tilavuus on aina 22,4 l. Tämä arvo vastaa arvoa moolitilavuus kaasuja. Nämä suhteet ovat erittäin tärkeitä stoikiometria.
Tämä saattaa tuntua oudolta, koska voi syntyä seuraava kysymys: Kuinka kaasut, joissa on erikokoisia molekyylejä ja atomeja, voivat viedä saman tilavuuden?
No, tämä johtuu siitä, että kaasumolekyylit ovat niin kaukana toisistaan, että molekyylien koko on merkityksetön.
Tällä tavoin Avogadron mittalaki selitti Gay-Lussacin mittalain. Huomaa alla, että kaksi vetymolekyyliä (kaksi tilavuutta) reagoi yhden happimolekyylin (yksi tilavuus) kanssa muodostaen kaksi vesimolekyyliä (kaksi tilavuutta). Vedellä ja vedyllä on sama tilavuus, koska niillä on sama määrä molekyylejä, kuten Avogadron laissa todetaan.
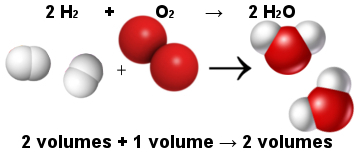
Molekyylien välinen suhde veden muodostumisreaktiossa
Samalla Avogadron laki sai atomiteorian toimimaan, koska huomaat, että sekä reagensseissa että tuotteissa on yhteensä 6 atomia (4 vetyä ja 2 happea).
Nämä tilavuuslait olivat erittäin tärkeitä käsitteen kehitykselle molekyylejä.
* Kuva on suojattu tekijänoikeuksilla: rook76 / Shutterstock.com
Kirjailija: Jennifer Fogaça
Valmistunut kemian alalta
Haluatko viitata tähän tekstiin koulussa tai akateemisessa työssä? Katso:
FOGAÇA, Jennifer Rocha Vargas. "Gay-Lussacin mittalaki"; Brasilian koulu. Saatavilla: https://brasilescola.uol.com.br/quimica/lei-volumetrica-gay-lussac.htm. Pääsy 28. kesäkuuta 2021.
Mitä ovat kaasut, mitkä ovat kaasujen ominaisuudet, molekyyliyhdisteet, puristettavuus, kiinteä tilavuus, kineettinen energia kaasun keskimääräinen absoluuttinen lämpötila, ihanteellinen kaasu, todelliset kaasut, täydellinen kaasu, kaasun tilamuuttujat, kaasun tilavuus, vuodenajat
Kemia

Gay-Lussac-lait, Proust-laki, kemiallinen reaktio, vakio-osuus, ainemassat, puhdas aine, analyysi kvalitatiivinen ja kvantitatiivinen, täydellisten kaasujen laki, vakio-osuuksien laki, tiettyjen mittasuhteiden laki, laki tilavuus.