THE entalpia (H) vastaa aineen energiasisältöä. Mutta toistaiseksi on mahdollista määrittää vain arvon entalpian vaihtelu (∆H) kemiallisten prosessien Tämä tapahtuu vähentämällä lopullista entalpiaa (tuotteiden) alkuperäisellä entalpialla (reagoivilla aineilla).
∆H = HLOPULLINEN - HALKUKIRJAIN tai ∆H = HTUOTTEET - HREAGENSSIT
Entalpian vaihtelun tyyppi on tavallista verrata prosessissa mukana olevaan kemialliseen ilmiöön. Esimerkiksi kun komposti palaa, laskemme palamisentalpian vaihtelu (∆Hpalaminen).
Kun entalpia mitataan 1 moolille ainetta vakio-olosuhteissa (1 atm ja 25 ° C), sanotaan, että meillä on tavallinen entalpia, symboloi ∆HO. Joten meillä on:

Palamisreaktiot sisältävät aina a polttoainetta, jotka ovat syttyviä aineita, jotka voivat olla missä tahansa kolmesta fysikaalisesta tilasta, ja joihin liittyy myös a hapetin, kumpi on happikaasu.
Älä lopeta nyt... Mainonnan jälkeen on enemmän;)
Palaminen voi tapahtua kokonaan tai epätäydellisesti. Entalpian vakioalue määritetään vain täydellisille palamisille.
Kun polttoaine on aine, joka koostuu vain hiilestä, vedystä ja / tai hapesta, täydellinen palaminen tuottaa vain hiilidioksidia ja vettä, kuten alla olevissa esimerkeissä esitetään:- Metaanin täydellinen palaminen, CH4 g)
CH4 g) + ½2 → 1 CO2 g) + 2 H2O(ℓ) .H0palaminen = -890,4 kJ / mol
- Etanolin täydellinen palaminen, C2H6O(1)
1C2H6O(ℓ)+ 3O2 → 2 CO2 g) + 3 H2O(ℓ) .H0palaminen = -1366,1 kJ / mol
- Butaanin täydellinen palaminen, C4H10 (g)
2C4H10 (g)+ 13O2 → 8 CO2 g) +10 H2O(ℓ) .H0palaminen = -2878,6 kJ / mol

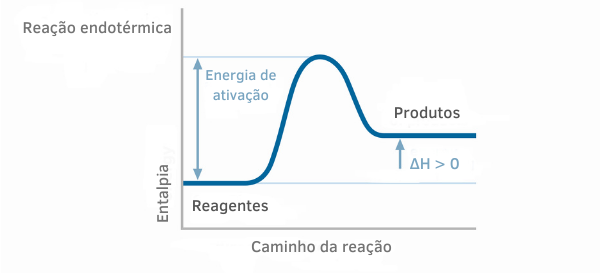
Huomaa, että kaikissa tapauksissa arvot.H0palaminen ovat negatiivisia (∆H0palaminen = < 0), tämä johtuu siitä, että palamisreaktiot vapauttavat energiaa (ne ovat eksotermisiä), joten lopullinen entalpian arvo on alhaisempi kuin alkuperäinen.
Kirjailija: Jennifer Fogaça
Valmistunut kemian alalta
Haluatko viitata tähän tekstiin koulussa tai akateemisessa työssä? Katso:
FOGAÇA, Jennifer Rocha Vargas. "Palamisen entalpia"; Brasilian koulu. Saatavilla: https://brasilescola.uol.com.br/quimica/entalpia-combustao.htm. Pääsy 27. kesäkuuta 2021.