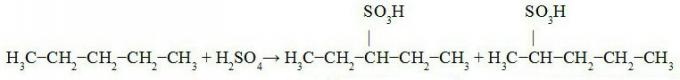THE oktettiteoria ehdotti Newton Lewis, joka tutkimuksissa havaitsi atomien vuorovaikutuksen tapahtuvan niin että jokainen elementti saa jalokaasun elektronisen vakaudeneli kahdeksan elektronia valenssikerros. Joissakin molekyyleissä tapahtuu kuitenkin niin kutsuttu oktetin laajeneminen tai supistuminen, ts. Keskiatomi muodostaa enemmän tai vähemmän ennustettuja sidoksia.
Lue myös: Kovalenttinen sidos - luokitukset ja ominaisuudet
Kuinka oktettiteoria toimii?
Tietenkin kaikki järjestelmät etsivät tapaa saada mahdollisimman paljon vakautta, ja tämä ei ole erilainen atomin kanssa. Atomit ovat minkä tahansa aineen "emäshiukkasia", ja niiden jokaisessa rakenteessa on elektropallo. Tämä sähköpallo jaettiin Linus Pauling energiatasoissa ja alatasoissa. Pauling kehitti kaavion osoittaakseen miltä elektronien jakautuminen atomin ytimen ympärillä näyttäisi.
Katso alla oleva kuva:

Jokaisella tasolla ja alatasolla on määrä elektronit. Vastaamalla voimme sanoa, että jokainen taso on hylly ja jokainen alataso on laatikko. Asenna jokaiseen laatikkoon kaksi elektronia. Atomi on vakaa, kun kaikki sen elektronit ovat pariksi, toisin sanoen kun on kaikki laatikot, joissa on kaksi elektronia.
Esimerkki:
Tehdään elektroninen hapen (O) jakelu, jonka luonnollisessa tilassa on kahdeksan elektronia.

Huomaa, että valenssikerroksessa (L-kerros p-alatasossa) meillä on kaksi parittamatonta elektronia. Nämä elektronit muodostavat kemialliset sidokset muiden alkuaineiden kanssa haluavat muodostaa elektronisia pareja.
Oktettiteoria perustuu elektronien yhteenlaskemisen matematiikkaan. Jos viimeisen elektronikuoren kaikilla alatasoilla on kaksi elektronia, valenssikuoressa on yhteensä kahdeksan elektronia ja siten atomi on vakaa.
Lue myös: Kvanttiluvut - elektronienergian määrään liittyvät numerot
Älä lopeta nyt... Mainonnan jälkeen on enemmän;)
jalokaasut
Jalokaasut ovat ainoat alkuaineet löytyy luonnosta monoatomisessa muodossa, toisin sanoen luomatta sidosta toiseen atomiin. Tämä johtuu siitä, että niissä on elektroninen vakaus. Lähes kaikilla heillä on kahdeksan elektronia valenssikuoressa., noudattaen oktettisääntöä, lukuun ottamatta heliumkaasua, jossa on vain kaksi elektronia.

Poikkeukset oktettiteoriasta
Jotkut yhdisteet onnistuvat stabiloitumaan, kun valenssikuoressa on enemmän tai vähemmän kuin kahdeksan elektronia. Näissä tapauksissa esiintyy poikkeuksia oktettiteoriaan.
oktetin laajennus
Se tapahtuu pääasiassa fosforin (P) ja rikin (S) kanssa, jotka ovat suhteellisen suuria atomeja ja joiden alataso on "d". Tässä tapauksessa atomi pitää viimeisessä kuoressaan yli kahdeksan elektronia.
Esimerkki:

Rikkiheksafluoridin tapauksessa keskeinen alkuaine jäi 12 elektronia, joka ylittää 8: n, joka vaaditaan stabiloitumaan oktettisäännön mukaisesti. Tässä tapauksessa oktetti laajeni.
oktetin supistuminen
Tapahtuu berylliumin (Be), boorin (B) ja joidenkin kanssa oksidit typpeä. Katso esimerkki:

Booritrifluoridin tapauksessa fluoriatomit hankkivat tarvittavat kahdeksan elektronia valenssikuoressa jakamalla elektroninen boorilla, kunnioittaen oktettisääntöä, mutta keskiatomi (boori) ei vakautu kuuden elektronin kanssa, mikä tapahtuu yksi oktetin supistuminen.
Pääsy myös: Sigma-linkin luokitus: mitkä ovat kriteerit?
ratkaistut harjoitukset
Kysymys 1 - (Mackenzie-SP) Jotta rikki- ja kaliumatomit saisivat elektronisen konfiguraation yhtä kuin jalokaasu, on välttämätöntä, että:
(Tiedot: atomiluku S = 16; K = 19.)
A) rikki vastaanottaa 2 elektronia ja kalium saa 7 elektronia.
B) rikki antaa 6 elektronia ja kalium saa 7 elektronia.
C) rikki tuottaa 2 elektronia ja kalium 1 elektronin.
D) rikki vastaanottaa 6 elektronia ja kalium luovuttaa yhden elektronin.
E) rikki vastaanottaa 2 elektronia ja kalium luovuttaa 1 elektronin.
Resoluutio
Vaihtoehto E. Rikki on sarakkeen 16 tai ryhmän 6A osa. Tämän perheen elementit vastaanottavat yleensä kaksi elektronia muodostamaan elektronisia pareja, ja valenssikuoressa on yhteensä kahdeksan elektronia. 1A-perheen elementeillä, jotka ovat alkalimetalleja, valenssikuoressa on vain yksi elektroni. Lahjoittamalla tämä elektroni edellisestä kerroksesta tulee valenssikerros, jo kahdeksan elektronin kanssa, oktettisäännön sanelemana.
Kysymys 2 - Tuomitse seuraavat väitteet tosi (T) tai väärä (F).
I () Oktetin säännön mukaan valenssikuoressa tarvitaan kahdeksaa elektronia, jotta atomi pysyy vakaana.
II () Valenssikerros on atomin toinen elektroninen kerros.
III () Kloori (Cl), halogeeniperheestä, pyrkii saamaan kaksi elektronia vakauden saavuttamiseksi.
IV () Natrium (Na), 1A-perheen osa, pyrkii menettämään ainoan elektronin valenssikuoressaan.
Merkitse oikea vaihtoehto:
A) I, III ja IV ovat totta.
B) I ja IV ovat totta.
C) Vain II on totta.
D) Vain IV on väärä.
E) Kaikki ovat totta.
Resoluutio
Vaihtoehto B. Minä ja IV ovat totta. Lausunto II on väärä, koska valenssikerros on atomin viimeinen elektroninen kerros, ei toinen. Ja lausunnossa III sanotaan, että kloorilla on taipumus saada kaksi elektronia, mikä ei kloorin jälkeen ole peräisin Kuvissa 7A tai 17 kuvattu perhe pyrkii saamaan vain yhden elektronin saadakseen siten kaasun elektronisen konfiguraation jalo.
Kirjoittanut Laysa Bernardes Marques de Araújo
Kemian opettaja