Tekstissä "Pitoisuus mol / l tai moolisuus"Huomasit, että pitoisuus mol / l viittaa liuenneen aineen määrään (n1, mitattuna moolina) liuoksen tilavuudella litroina (V). On kuitenkin joitain liuenneita aineita, jotka veteen laitettuina synnyttävät ioneja.
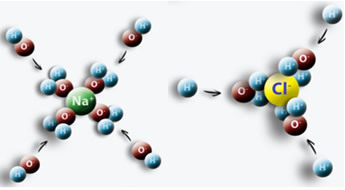
Esimerkki on se, että panemme suolaa (NaCl) veteen, veteen kohdistuvan positiivisen napan kanssa Cl: n kanssa ja negatiivisen napaan Na: n välillä syntyy vetovoima, mikä aiheuttaa Na-ioneja+ ja Cl-.
On tärkeää tietää, miten näiden ionien pitoisuus mol / l määritetään, koska se voi olla hyödyllistä monissa tilanteissa. Yksi alue, joka käyttää tätä, on lääke, erityisesti lääketieteellisissä verikokeissa. Veressämme ja muissa ruumiinnesteissämme on niihin liuenneita ioneja. Jos näiden ionien pitoisuus veressä on normaalin ylä- tai alapuolella, se voi vaarantaa kehomme moitteettoman toiminnan ja johtaa häiriöihin ja sairauksiin.
Katso rautaionien tapaus (Fe2+): jos henkilöltä puuttuu tämä ioni, hän voi kehittää anemiaa. Joten kun anemiaa sairastavalle kerrotaan tarvitsevansa kuluttaa runsaasti rautaa sisältäviä elintarvikkeita tai jopa rautaa sisältäviä lääkkeitä, se on itse asiassa rauta-ioni eikä metallinen alkuaine.
Toinen tapaus on, kun kalsiumionien menetys (Ca2+) luissa, aiheuttaen osteoporoosia, kuten kuvissa näkyy suurennetuilla luiden kuvilla alla:

Katso muita esimerkkejä ioneista, joilla on elintoimintoja kehossamme ja joiden on oltava oikeassa pitoisuudessa:

Siksi näiden tietojen perusteella käy selväksi, että tietäminen siitä, miten lasketaan ionien pitoisuus liuoksissa, on todella tärkeää. Mutta miten tämä voidaan tehdä?
Liuoksissa olevien ionien pitoisuudet mol / l on mahdollista määrittää, jos tiedetään kaksi olennaista tietoa, jotka ovat:
- Veteen liuotettujen aineiden kaavat;
- Ratkaisujen molaarisuus.
Kun nämä tiedot ovat kädessä, kirjoita kyseessä olevan liuenneen aineen dissosiaatio- tai ionisaatioyhtälö ja etsi vähentämällä ionien pitoisuus se on verrannollinen kunkin ionin moolien määrään. Tämä tarkoittaa, että ionien pitoisuus on verrannollinen niiden vastaaviin kertoimiin ionisaatio- tai dissosiaatioyhtälössä.
Älä lopeta nyt... Mainonnan jälkeen on enemmän;)
Katso seuraava esimerkki ymmärtääksesi paremmin tämän laskutoimituksen:
"Katsotaan, että tietyn magnesiumfosfaatin vesiliuoksen (Mg3(PÖLY4)2 on 0,5 mol / l. Mikä on magnesiumkationien pitoisuus mol / l (Mg2+(tässä)) ja fosfaattianionit (PO3-4 (aq)) tässä ratkaisussa, kun otetaan huomioon, että dissosiaation aste (α) oli 100%? "
Ensimmäinen vaihe tämän ongelman ratkaisemisessa on dissosiaatio- tai ionisaatioyhtälön kirjoittaminen. Jos sinulla on vaikeuksia, voit perustaa itsesi alla olevaan yleiseen yhtälöön:
1 AxBy → x A+ y + y B-x
1 mol x mol y mol
Joten, kun otetaan huomioon tässä esimerkissä, että magnesiumfosfaatti hajosi täysin, meillä on seuraava yhtälö:
1 mg3(PÖLY4)2 (aq) → 3 mg2+(tässä) + 2 gp3-4 (aq)
1 mol 3 mol 2 mol
Voimme nähdä, että 1 mooli Mg: tä3(PÖLY4)2 antaa 3 mol Mg: tä2+(tässä) ja 2 mol PO: ta3-4 (aq); täten kationin moolien lukumäärä on 3 kertaa fosfaatin moolien lukumäärä, jolla liuos valmistettiin, ja anionien lukumäärä on 2 kertaa.
Koska liuos on 0,5 mol / l Mg: tä3(PÖLY4)2 (aq) , tämä tarkoittaa, että 0,5 mol Mg liuotettiin 1 litraan sitä3(PÖLY4)2, josta saatiin 1,5 mol / l Mg: tä2+(tässä) ja 1,0 mol / l PO: ta3-4 (aq):
1 mg3(PÖLY4)2 (aq) → 3 mg2+(tässä) + 2 gp3-4 (aq)
1 mol 3 mol 2 mol
0,5 mol x y
1. 0,5 3. 0,5 2. 0,5
0,5 mol / l 1,5 mol / l1,0 mol / l
Mutta entä jos dissosiaation tai ionisaation aste ei olisi 100%? Oletetaan, että se oli 70%, miten menisimme selvittämään näiden ionien mol / L-pitoisuuden?
Suorita siinä tapauksessa yksinkertainen sääntö kolmesta. Katso alempaa:
1,5 mol / l Mg: tä2+(tässä) 100 %
x 70%
x = 70. 1,5 → x = 1,05 mol / l Mg-ioneja2+(tässä)
100
1,5 mol / l PO: ta3-4 (aq) 100 %
y 70%
y = 70. 1,0 → y = 0,70 mol / l PO-ioneja3-4 (aq)
100
Kirjailija: Jennifer Fogaça
Valmistunut kemian alalta
Haluatko viitata tähän tekstiin koulussa tai akateemisessa työssä? Katso:
FOGAÇA, Jennifer Rocha Vargas. "Ionipitoisuus mol / l"; Brasilian koulu. Saatavilla: https://brasilescola.uol.com.br/quimica/concentracao-dos-ions-mol-l.htm. Pääsy 28. kesäkuuta 2021.
Kemia

Dissosiaatio ja ionisaatio, italialainen tutkija Volta, sähkövirta, ruotsalainen fyysinen kemisti Svant August Arrhenius, teoria Arrhenius, positiiviset ionit, kationit, negatiiviset ionit, anionit, kaustinen sooda, pöytäsuola, napamolekyylit, dissosiaatio ioninen,