Sekä syklaanit, alkeenit, alkyynit, muun muassa alkadieenit kärsivät myös puheluista lisäysreaktiot. Tekstissä noin reaktiot dieeneissä, huomaat, että lisäysreaktiot riippuvat dieenin tyypistä, jota käsitellään. Dieenit voidaan luokitella laajasti:
tiivistetty tai kertynyt (ei kaksinkertaista sidosta kahden tuplan välillä);
Esimerkki: H2C = CH-CH3
konjugoitu tai vuorotellen (vain yksi sidos kahden tuplauksen välillä);
Esimerkki: H2C = CH — CH = CH2
eristetty (vähintään kaksi yksittäistä sidosta kahden tuplauksen välillä).
Esimerkki: H2C = CH-CH2—CH2-CH = CH2
Diels-Alder-reaktio kehitti vuonna 1928 kaksi saksalaista kemistiä, Otto Paul Hermann Diels ja Kurt Alder. Tämä on erittäin tärkeä reaktio orgaanisessa kemiassa, koska se sallii:
tunnistaa dieenihiilivedyt;
saada tyydyttyneitä syklisiä hiilivetyjä (mieluiten sykloheksaanit).
Tämä orgaaninen reaktio tapahtuu vain alkadieenit tai konjugoidut tai vaihtoehtoiset dieenit ja sitä kutsutaan lisäys 1.4. Yhdiste, jossa voimme havaita 1,4-lisäyksen yksinkertaisemmalla tavalla, on but-1,3-dieeni, jota kuvataan alla:
H2C = CH — CH = CH2
MERKINTÄ: Tässä yhdisteessä esiintyy resonanssiilmiö, jossa kahden pi-sidoksen elektronit liikkuvat ketjun läpi. Pari pi-elektronit alkaa miehittää ketjun keskeistä aluetta (hiilen 2 ja 3 välillä), kun taas toisen pi-sidoksen elektronit siirtyvät toiseen päähiilistä. Siten meillä on sitoutumiskohtia hiileissä 1 ja 4 ja kaksinkertainen hiileen 2 ja 3.

Resonanssi but-2,3-dieenirakenteessa
Älä lopeta nyt... Mainonnan jälkeen on enemmän;)
Klo Diels-Alder-reaktio, yksi reagensseista on konjugoitu dieeni, kun taas toinen on orgaaninen yhdiste, joka voi esiintyä soitto kaksinkertainen hiiliatomien välillä. Alla on esimerkki a Diels-Alder-reaktio but-2,3-dieenin ja propeenin välillä:
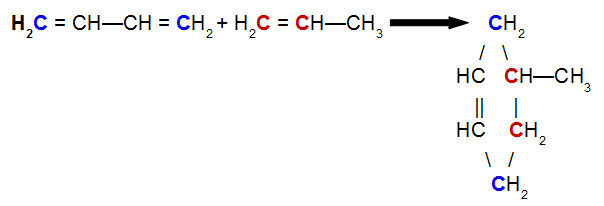
But-2,3-dieenin ja propeenin Diels-Alder-reaktion yhtälö
Analysoimalla yllä olevaa yhtälöä voimme nähdä, että but-2,3-dieenisidoksen hiilet 1 ja 4 (molemmat sinisinä) propeenin hiileille 1 ja 2 (molemmat punaisia), jolloin syntyy haaroittunut sykleeni, 4-metyylisyklohekseeni. Tämä johtuu resonanssista but-2,3-dieenimolekyylissä, joka siirtää pi-sidoksen hiilen 2 ja 3 välillä, ja pi-sidoksen rikkoutumisesta propeenin hiilien 1 ja 2 välillä.
OBS.²: On tärkeää korostaa, että riippumatta yhdisteestä, joka reagoi konjugoidun alkadieenin kanssa, pi-sidoksessa tapahtuu katkos vain ketjun hiiliatomien välillä. Jos rakenteessa on pi-sidoksia muiden atomien kuin hiilen välillä, ne eivät hajoa. Alla on esimerkki rakenteesta, joka voi reagoida a: n kanssa alkadieeni jonkin sisällä Diels-Alder-reaktio, mikä johtaa pi-sidoksen katkeamiseen kaksoissidoksen hiilen (sinisellä) välillä.
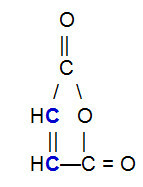
Maleiinihappoanhydridin rakennekaava
Minun luona. Diogo Lopes Dias
Haluatko viitata tähän tekstiin koulussa tai akateemisessa työssä? Katso:
PÄIVÄT, Diogo Lopes. "Diels-Alder-reaktiot"; Brasilian koulu. Saatavilla: https://brasilescola.uol.com.br/quimica/reacoes-diels-alder.htm. Pääsy 28. kesäkuuta 2021.
Kemia

Alkaanit, kaasu, eteeni, eteeni, muovit, synteettinen kumi, väriaineet, synteettiset kankaat, räjähteet, öljykrakkaus, polyetyleeni, olefiittikaasu, olefiinit, hiilivedyt, ketju asyklinen hiilidioksidi.