O natriumkloridia (pöytäsuola) on suola, jota käytämme jokapäiväisessä elämässämme käsityönä valmistettujen tai jalostettujen (teollisten) elintarvikkeiden suolaan. Se on aine, jota esiintyy myös erilaisissa luonnollisissa elintarvikkeissa, joita kulutamme päivittäin, kuten hedelmissä, vihanneksissa, palkokasveissa, siemenissä jne.
Tässä tekstissä tiedät kaiken tästä tärkeästä aineesta ihmisen jokapäiväisessä elämässä:
määritelmä
Natriumkloridi kuuluu suolojen epäorgaaniseen toimintaan ja se muodostuu natriumkationin (Na+) se on anioni csielläoreto (Cl-) kautta a ionisidos.
b) Kemialliset ominaisuudet
Natriumkloridi muodostuu kahdesta kemiallisesta alkuaineesta:
→ Natrium (Na):
kuuluu metallien perheeseen (joka kykenee muodostamaan helposti kationeja) emäksinen (AI);
on elektroni valenssikuoressa;
on atomiluku yhtä suuri kuin 11;
on korkea sähköpositiivisuus (kyky menettää elektroneja).
→ Kloori (Cl)
kuuluu halogeenien perheeseen (VIIA);
se on ei-metalli (siksi siitä tulee anioni niin helposti);
on seitsemän elektronia valenssikuoressa;
on atomiluku yhtä suuri kuin 17;
on korkea elektronegatiivisuus (kyky hankkia elektroneja).
Koska läsnä on kaksi natriumkloridia muodostavaa kemiallista elementtiä, on korkea sähköpositiivisuus ja korkea elektronegatiivisuus, niiden välillä on ionisidos (muodostunut atomien välillä, joilla on taipumusta menetykseen ja voittoon elektronit).
Natriumkloridin kemiallinen rakenne koostuu yhdestä kloridianionista (vihreä pallo), joka on vuorovaikutuksessa kuuden natriumkationin (sinisen pallon) kanssa, kuten alla olevasta rakenteesta voidaan nähdä:
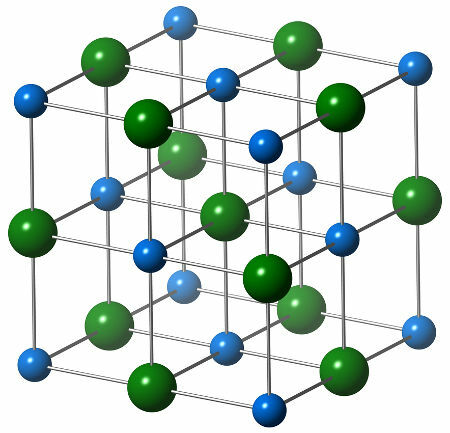
Esitys natriumkloridin kiderakenteesta
c) Fyysiset ominaisuudet
Fuusiopiste:
Natriumkloridi voidaan muuntaa kiinteästä tilasta nestemäiseksi 801: n lämpötilassa OÇ.
Kiehumispiste:
Natriumkloridi voidaan muuntaa nestemäisestä kaasumaiseen tilaan 1465 ° C: n lämpötilassa OÇ.
Vastakkaisuus
Natriumkloridi on polaarinen, koska se on ionisidoksen alkama aine, koska se on ioninen yhdiste.
Vesiliukoisuus
Voimme liuottaa 1 litraan vettä 25 ° C: ssa OC, enintään 359 grammaa natriumkloridia.
Liukoisuus muihin liuottimiin:
Koska natriumkloridi on polaarinen yhdiste, sitä ei voida liuottaa mihinkään luonteeltaan ei-polaariseen liuottimeen, kuten öljyyn.
Tiheys:
Natriumkloridin tiheys on 2,165 g / ml, joten se on tiheämpää kuin vesi, jonka tiheys on 1 g / ml.
Sähkönjohtavuus:
Koska se on ioninen yhdiste, natriumkloridi pystyy johtamaan sähkövirtaa vain, jos:
-
Se on sulassa tilassaan eli nestemäisessä muodossa;
Älä lopeta nyt... Mainonnan jälkeen on enemmän;)
Liukenee veteen.
d) Menetelmät saamiseksi
Natriumkloridia voidaan saada fysikaalisesti tai kemiallisesti:
1O) Fyysinen:
murtokiteytys
Natriumkloridi saadaan haihduttamalla vettä valtameristä.
maanalaiset kaivokset
Se uutetaan kaivoksissa kaivostekniikoilla.
maanalaiset kerrostumat
Se uutetaan syvistä maanalaisista kerrostumista liuottamalla veteen (kerroksessa oleva suola liukenee) ja pumppaamalla sen jälkeen.
2O) Hankinta kemiallisesti
synteesireaktio
Natriumkloridia voidaan saada synteesin kemiallisesta reaktiosta (yksinkertaisista aineista syntyy yhdisteaine) kloorikaasun ja metallisen natriumin välillä:
2 tuumaas + Cl2 g) → 2 NaCls
Neutralointireaktio:
Toinen tapa saada natriumkloridi kemiallisesti on suolahapon ja natriumhydroksidin välinen neutralointireaktio, jossa muodostuu suolaa ja vettä:
HCl(1) + NaOH(tässä) → NaCl(tässä) + H2O(1)
e) Tärkeys ihmisille
Natriumkloridilla ei itsessään ole mitään toimintaa ihmiskehossa, mutta kun se hajoaa natriumkationeiksi (Na+) ja kloridianionit (Cl-), kullakin näistä kahdesta ionista on useita tärkeitä toimintoja kehollemme. Katso joitain näistä toiminnoista:
→ Natriumkationin (Na+)
Estää veren hyytymistä;
Taistelee munuaisten ja sappikivien muodostumista;
Osallistuu kehon nesteiden säätelyyn;
Osallistuu verenpaineen säätelyyn.
→ Kloridianionin (Cl-)
Osallistuminen mahalaukun mehun muodostumiseen ja rakentamiseen (suolahappo - HCI);
Osallistuminen haiman mehun muodostumiseen.
f) Ihmiskehon vaurioituminen
Liiallinen natriumkloridin kulutus voi aiheuttaa seuraavia haittoja ihmisille:
→ Ylimääräisten natriumkationien aiheuttamat vauriot kehossa:
Lisääntynyt haavan paranemisaika;
Lisääntynyt kouristukset;
Kohonnut verenpaine;
Munuaisten ylikuormitus;
Lisääntynyt nesteen kertyminen elimistöön.
→ Liiallisten kloridianionien aiheuttamat vauriot kehossa:
tuhoaminen E-vitamiini;
Jodituotannon väheneminen kehossa.
g) Muut sovellukset
Sen lisäksi, että natriumkloridia käytetään ruoan suolattamiseen, sitä voidaan käyttää myös seuraavissa tilanteissa:
Shampoo tuotanto;
Paperin tuotanto;
Tuottama Natriumhydroksidia (NaOH);
Pesuaineiden tuotanto;
Saippuan tuotanto;
Lunta sulaa paikoissa, jotka kärsivät lumimyrskyistä;
Metallisen natriumin tuotanto;
Kloorikaasun tuotanto;
Isotoniassa kehon elektrolyyttien korvaamiseen;
Nenän dekongestanttiliuoksissa;
Suolaliuoksen tuotanto; muiden sovellusten joukossa.
Minun luona. Diogo Lopes Dias
Haluatko viitata tähän tekstiin koulussa tai akateemisessa työssä? Katso:
PÄIVÄT, Diogo Lopes. "Natriumkloridi (pöytäsuola)"; Brasilian koulu. Saatavilla: https://brasilescola.uol.com.br/quimica/cloreto-sodio.htm. Pääsy 27. kesäkuuta 2021.
Ioniyhdisteet, ioniyhdisteiden pääominaisuudet, ionien välinen sitoutuminen, elektronien lopullinen siirto, sähköstaattiset vetovoimat ionien, negatiivisten ja positiivisten ionien, anionien, kationien, ionisidosten, molekyylirakenteen välillä hän
Kemia

Ionisidos, ionisten yhdisteiden, ionisten agglomeraattien, natriumkloridin, pöytäsuolan, ionisen aineen, sähköstaattiset vetovoimat, kloridianionit, natriumkationit, polaariset liuottimet, positiiviset ionit, kationit, negatiiviset ionit, anionit.