Ennen moolimassa ja moolinumero, katsotaanpa joitain tärkeitä määritelmiä tässä yhteydessä:
→ Molaarinen termi
Molar tulee sanasta molekyyli, mutta mikä on molekyyli tarkalleen? Se on joukko atomeja, jotka ovat yhteydessä toisiinsa kemiallisten sidosten kautta.
→ Molekyylipaino (MM)
Molekyylin massa on mahdollista laskea kunkin vastaavan molekyylin muodostavan atomin atomimassojen summalla. Tulosta kutsutaan molekyylimassaksi (MM).
Mikä olisi rikkivety (H2S) esimerkiksi?
Ensin sinun on tiedettävä mikä on atomimassa kunkin atomin, joka on annettu jaksollisessa taulukossa elementtejä.
Vedyn atomimassa (H) = 1 a.m.u. (yksikkö per atomimassa)
Rikin atomimassa (S) = 32,1 v.a.u.
Molekyylipaino on atomien atomimassojen summa.
Huomaa: H-molekyylin vety2S: n kerroin on 2, joten sinun on kerrottava sen massa 2: lla. Lasketaan:
H: n molekyylipaino2S = 1 • 2 + 32,1 = 34,1 u
(H) + (S) = (H)2S)
Moolimassa ja moolien lukumäärä
Älä lopeta nyt... Mainonnan jälkeen on enemmän;)
Moolimassa ja moolien lukumäärä liittyvät massaan Avogadron vakio (6,02 x 1023) seuraavan käsitteen avulla:
'' 1 mooliin sisältyvien alkeiskokonaisuuksien määrä vastaa Avogadron vakiota, jonka arvo on 6,02 x 1023 mol-1.''
Siksi moolimassa on 6,02 x 10 massa23 kemialliset kokonaisuudet ja ilmaistaan g / mol.
Miellekartta - Mol
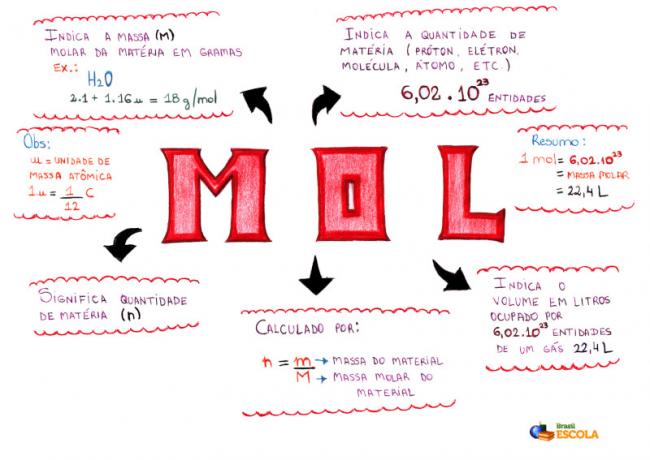
* Voit ladata mielikartan Klikkaa tästä!
Esimerkki: H2s
Molekyylipaino = 34,1 u
Moolimassa (M) = 34,1 g / mol
Tämä tarkoittaa, että pitoisuudella 34,1 g / mol rikkivetyä on 6,02 x 1023 molekyylit tai 1 mooli rikkivetymolekyylejä.
Johtopäätös
Molekyylimassalla ja moolimassalla on samat arvot, mikä eroaa mittayksiköstä. Moolimassa riippuu moolien lukumäärästä, joka saadaan Avogadron vakiosta.
* Minun mielikartta, Diogo Lopes
Kirjoittanut Líria Alves
Valmistunut kemian alalta
Haluatko viitata tähän tekstiin koulussa tai akateemisessa työssä? Katso:
SOUZA, Líria Alves de. "Moolimassa ja moolinumero"; Brasilian koulu. Saatavilla: https://brasilescola.uol.com.br/quimica/massa-molar-numero-mol.htm. Pääsy 27. kesäkuuta 2021.


