THE liukoisuusvoidaan määritellä suurin mahdollinen määrä liuennutta ainetta, joka voidaan liuottaa tiettyyn määrään liuotinta tietyssä lämpötilassa.
Tämä enimmäismäärä, joka voidaan liuottaa, tunnetaan myös nimellä liukoisuuskerroin tai liukoisuusaste. Mutta minkä tahansa aineen liukoisuus riippuu muun muassa liuottimen tyypistä, johon liuennut aine on dispergoitunut.
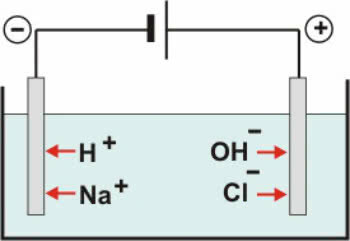
Esimerkiksi NaCl (natriumkloridi - pöytäsuola) liukenee hyvin veteen, ja 1 litraan vettä 20 ºC: ssa voimme liuottaa jopa 360 grammaa tätä suolaa. Mutta kun liuotin muuttuu bensiiniksi samoissa tilavuus-, lämpötila- ja paineolosuhteissa, suola ei liukene.
Miksi aineen liukoisuus vaihtelee niin paljon liuottimesta toiseen?
Yksi tekijöistä on vastakkaisuus mukana olevista yhdisteistä. Mainitussa esimerkissä meillä on, että suola on polaarinen, vesi on polaarinen ja bensiini ei-polaarinen. Suola muodostuu natriumin (Na) ja kloorin (Cl) atomeista, jotka sitoutuvat ionisidosten kautta, jolloin natrium luovuttaa ehdottomasti elektronin kloorille muodostaen Na-ioneja
+ ja Cl-. Koska näillä ioneilla on vastakkaiset varaukset, ne vetävät puoleensa ja pitävät yhdessä (Na+Cl-).
Tämä osoittaa meille, että suola on todella polaarinen, jokainen ionisidos on polaarinen, koska yhdisteen sähkövarauksissa on eroja.
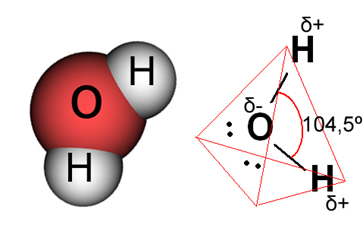
Veden tapauksessa olemassa oleva sidos on kovalenttinen, jossa kaksi vetyatomia jakavat elektroneja happiatomin kanssa. Vesimolekyylissä on kaksi dipolia, joissa hapella on osittain negatiivinen varaus ja vedyllä on osittain positiivinen varaus (δ- O ─ H 8+). Mutta nämä dipolit eivät kumoa toisiaan, koska vesimolekyyli kohtaa 104,5º kulmassa, mikä osoittaa, että jakautuminen ja varaus molekyyliä pitkin eivät ole tasaisia. Molekyylin happiatomilla on suurempi negatiivinen varaustiheys. Tämä osoittaa meille, että vesimolekyyli on todella polaarinen.
Älä lopeta nyt... Mainonnan jälkeen on muutakin ;)
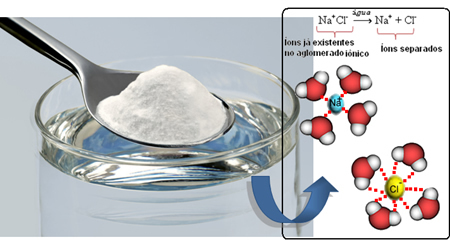
Joten kun sekoitamme suolaa veteen, suolan positiivinen osa, joka on Na-kationit.+, vetää puoleensa veden negatiivinen osa, joka on happea, ja suolan negatiivinen osa (Cl-anionit-) vetää puoleensa veden positiivinen osa (H+). Näin ollen liitto Na+Cl- se hajoaa, jolloin suola liukenee veteen.
Bensiini puolestaan muodostuu erilaisten hiilivetyjen seoksesta, jotka ovat ei-polaarisia, eli bensiinin sähkövarauksen jakautuminen on tasaista. Siten suola-ionit eivät ole vuorovaikutuksessa bensiinin kanssa, eikä se liukene.
Nämä ja muut vastaavat tapaukset johtavat seuraavaan johtopäätökseen:

Tätä ei kuitenkaan voida pitää yleisenä sääntönä, koska on monia tapauksia, joissa ei-polaariset liuenneet aineet liukenevat hyvin polaarisiin liuottimiin ja päinvastoin. Joten ymmärtääksemme miksi näin tapahtuu, meidän on otettava huomioon vielä toinen tekijä: tyyppi molekyylien välinen voima liuottimesta ja liuenneesta aineesta.
Laki tästä tekstissä: "Aineiden molekyylien välisen lujuuden ja liukoisuuden välinen suhde”.
Kirjailija: Jennifer Fogaça
Valmistunut kemiasta
Haluatko viitata tähän tekstiin koulussa tai akateemisessa työssä? Katso:
FOGAÇA, Jennifer Rocha Vargas. "Aineiden polariteetin ja liukoisuuden välinen suhde"; Brasilian koulu. Saatavilla: https://brasilescola.uol.com.br/quimica/relacao-entre-polaridade-solubilidade-das-substancias.htm. Käytetty 27.7.2021.