THE molekyyligeometriaeli molekyylin atomien järjestely voidaan määrittää kemian säännöllä Gillespie, jossa hän listaa keskiatomiin kiinnittyneiden atomien määrän ja pilvien lukumäärän elektroniikka.
Tieto molekyylin geometriasta on erittäin tärkeää, koska se auttaa meitä määritetään napaisuus ja näin ollen liukoisuus (samanlaisen liukenemisen säännön mukaan) samanlainen).
puhelun kanssa tetraedrinen geometria, ei ole erilainen. Katso kriteerit sen määrittämiseksi Gillespien sääntöjen mukaan:
Pentatomiset molekyylit (viisi atomia);
Elektronisten pilvien puuttuminen keskiatomista;
komposiittimolekyylit tai yhdisteanionit.
Jonkin verran esimerkkejä molekyyleistä, joiden geometria on tetraedrinen he ovat:
CH4

CH-rakennekaava4
Hiilen valenssikuoressa on neljä elektronia, ja kaikki nämä elektronit sitoutuvat vetyihin. Siksi hiilellä ei ole elektronista pilviä (ylimääräinen elektronipari).
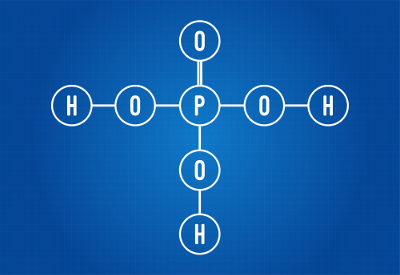
VAIN4-2

OS-rakennekaava4-2
Rikki, jonka valenssikuoressa on kuusi elektronia, muodostaa kaksi yksittäistä sidosta, joissa on kaksi happiatomia ja kaksi
datiiviset kovalenttiset sidokset kahden muun hapen kanssa. Yksittäissidoksissa se käyttää kahta elektronia ja kussakin datatiivissa toista kahta (yhteensä neljä dativeihin osallistuvaa elektronia), yhteensä kuusi elektronia. Sellaisena sillä ei ole enää pilviä.NH4+

NH-rakennekaava4+
Typpi, jonka valenssikuoressa on viisi elektronia, muodostaa kolme yksittäistä sidosta vetyatomien kanssa ja datiivisen sidoksen toisen vedyn kanssa. Yksittäisissä sidoksissa se käyttää kolmea elektroniaan ja datatiivisesti vielä kahta, yhteensä viisi elektronia. Sellaisena sillä ei ole enää pilviä.
CH3Cl

CH-rakennekaava3Cl
Älä lopeta nyt... Mainonnan jälkeen on enemmän;)
Hiilen valenssikuoressa on neljä elektronia, ja kaikki nämä elektronit sitoutuvat vetyihin ja klooriatomiin. Tästä syystä hiilellä ei ole elektronista pilviä.
→ Molekyylin napaisuus
Tietäen, että tietyllä molekyylillä on tetraedrinen geometria, voimme määrittää sen napaisuuden äärimmäisen yksinkertainen muoto, koska molekyylillä on neljä napaa varattu (neljä ligandia atomissa keskusta). Tätä varten riittää tietää sideaineiden ominaisuudet ja ottaa huomioon yksi seuraavista säännöistä:
Jos pilvien lukumäärä on yhtä suuri kuin yhtäläisten ligandien lukumäärä = ei-polaarinen molekyyli;
Jos pilvien lukumäärä eroaa yhtäläisten ligandien lukumäärästä = polaarinen molekyyli.
Seuraavissa kahdessa molekyylissä, joiden geometria on tetraedrinen, voimme soveltaa yllä olevia sääntöjä ja osoittaa niiden napaisuuden:
Metaanimolekyyli

Yhtä suuret ligandit metaanimolekyylissä
Metaanimolekyylissä on neljä elektronipilveä (neljä yksittäistä sidosta) ja myös neljä vetyatomia, jotka ovat kiinnittyneet keskiatomiin. Täten, meillä onneljäpilviä ja neljä yhtä suurta sideainetta, pian molekyyli on ei-polaarinen.
Havainto: Jos ainemolekyyli on anteeksipyyntö, se liukenee hyvin toiseen aineeseen, jonka molekyylit ovat myös ei-polaarinen.
Kloorimetaanimolekyyli

Yhtä suuret ligandit kloorimetaanimolekyylissä
Kloorimetaanimolekyylissä on neljä elektronipilveä (neljä yksittäistä sidosta) ja kolme vetyatomia ja yksi klooriatomi, joka on kiinnitetty keskiatomiin. Täten, meillä onneljäpilvet ja kolme yhtä suurta ligandia (kolme vetyä); pian, molekyyli on polaarinen.
Havainto: Jos ainemolekyyli on napa, se liukenee hyvin toiseen aineeseen, jonka molekyylit ovat myös polaarinen.
Minun luona. Diogo Lopes Dias
Haluatko viitata tähän tekstiin koulussa tai akateemisessa työssä? Katso:
PÄIVÄT, Diogo Lopes. "Tetraedrinen geometria"; Brasilian koulu. Saatavilla: https://brasilescola.uol.com.br/quimica/geometria-tetraedrica.htm. Pääsy 28. kesäkuuta 2021.