Tavaliselt reaktsioonid vesilahuse elektrolüüs ja tardelektrolüüs need viiakse läbi grafiidi ja plaatina elektroodidega, mis ei osale reaktsioonis; nad juhivad ainult elektrivoolu. Siiski on mõned konkreetsed juhtumid, kus seda on vaja kasutada aktiivsed elektroodidsee tähendab, et nad läbivad redutseerimise ja oksüdeerumise.
Nende redoksprotsessis osalevate elektroodide peamised kasutusjuhtumid on: a metallide elektrolüütiline puhastaminenagu tsink, koobalt, nikkel ja eriti vask; ja ka galvaniseerimine. Vaatame, kuidas iga juhtum toimub:
• Vase elektrolüütiline puhastamine: see elektrolüütiline vase rafineerimine võib anda puhtusastme umbes 99,9% ja seda kasutatakse peamiselt valmistamiseks vasktraadid, mis vähima lisandi korral võivad juhtida väga elektrivoolu vähenenud.
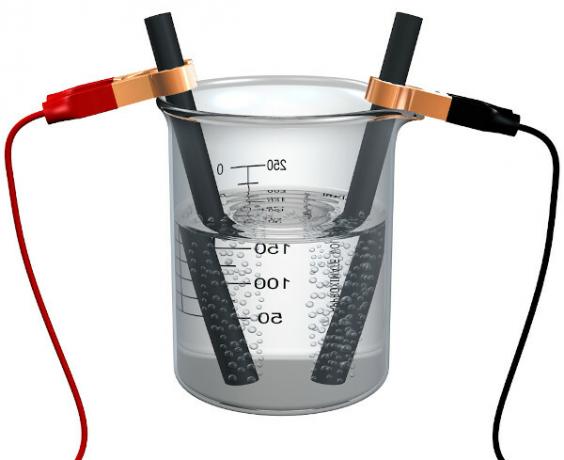
Vaadake, kuidas see protsess toimub, vaadates allpool kokku pandud elektrolüütilise vaadi skeemi:

Potentsiaalset erinevust rakendatakse vasksulfaadi vesilahusele (CuSo4 (aq)) - mis juhib elektrit - nii et anood, mis on ebapuhas metallvask, kaotab elektronid, see tähendab, et see oksüdeerub, vabastades katioonid (Cu
2+), mis ladestuvad negatiivsele plaadile. See võib olla inertne plaatina plaat või, parem, puhas vask plaat. See moodustab katoodi, mis redutseerub, kui vask sinna ladestub. Seega on elektroodides esinevad poolreaktsioonid järgmised:Ärge lõpetage kohe... Peale reklaami on veel;)
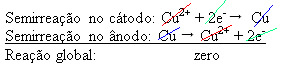
Asjaolu, et see andis nulli tulemuse, näitab, et keemilist reaktsiooni ei toimunud, vaid toimus ainult vase transport. Anuma põhjas on muud vases olnud ebapuhas ained nagu kuld, hõbe, ränidioksiid (liiv) ja muud mineraalid, mida saab isegi müüa.
• Galvaniseeritud: korrosiooni eest kaitstavale materjalile kantakse metallkate.
Katte jaoks valitud metall - mis võib olla kroom (kroomitud), nikkel (nikkel), hõbe (hõbetatud), kuld (kullamine) või tsink (tsingimine) - on anood, positiivne elektrood, mis läbib oksüdatsiooni, kaotades elektrone. See oksüdeerub kaitstud materjali asemel, kuna selle redutseerimispotentsiaal on suurem.
Negatiivne elektrood, see tähendab katood, mis võtab vastu need elektronid ja läbib redutseerimise, on materjal ise, mis oli kaetud. Nii jääb see kaitstud ka siis, kui selle pinda kuidagi rikutakse.
Autor Jennifer Fogaça
Lõpetanud keemia
Kas soovite sellele tekstile viidata koolis või akadeemilises töös? Vaata:
FOGAÇA, Jennifer Rocha Vargas. "Elektrolüüs aktiivsete elektroodidega"; Brasiilia kool. Saadaval: https://brasilescola.uol.com.br/quimica/eletrolise-com-eletrodos-ativos.htm. Juurdepääs 28. juunil 2021.