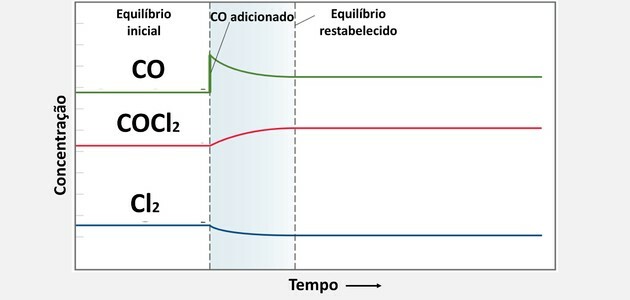
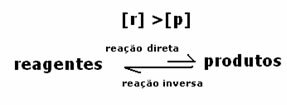
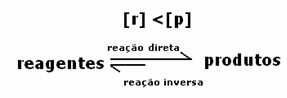
Reaktsiooni dünaamiline tasakaal või keemiline tasakaal tekib siis, kui edasi- ja tagasireaktsioonid toimuvad üheaegselt. Neid nn pöörduvaid süsteeme tähistavad nooled mõlemas suunas:  või
või  . Ülaloleval pildil on joodgaasi ja vesinikdioksiidi vahel toodud näide pöörduvast reaktsioonist.
. Ülaloleval pildil on joodgaasi ja vesinikdioksiidi vahel toodud näide pöörduvast reaktsioonist.
Reaktsiooni alguses on reagentide kogus maksimaalne ja toodete null. Reageerivad ained reageerivad omavahel, vähendades nende kontsentratsiooni ja suurendades moodustunud saaduste kontsentratsiooni. Samuti väheneb otsese reaktsiooni arengukiirus.
Kui toodete kontsentratsioon suureneb, algab pöördreaktsioon ja reaktandid moodustuvad uuesti; suureneb ka pöördreaktsiooni arengukiirus.
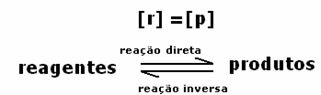
Keemilise tasakaalu saavutamisel püsival temperatuuril on edasisuunas ja vastupidises reaktsioonis arengukiirused võrdsed.
Kõikotsene = Kõik tagurpidi
Määrad on samad, kuid kontsentratsioonid mitte. Reagentide ja saaduste kontsentratsioonid ei ole tõenäoliselt ühesugused. Ainult harvadel juhtudel see juhtub. Enamasti on reagentide kontsentratsioon suurem kui toodete kontsentratsioon või vastupidi.
Seega on meil kolm võimalust, kuidas graafiliselt esitada arengumäärasid - otsesed ja pöördreaktsioonid, mis seovad reaktantide ja saaduste kontsentratsiooni reaktoris aeg. Vaatame iga juhtumit:
1. juhtum: Võrdsed kontsentratsioonid:
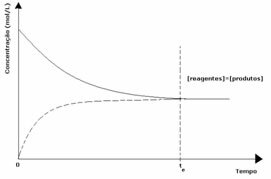
Nagu graafikult näha, on ajahetkel tja edasised ja vastupidised reaktsioonid on samad, sel juhul on reagentide ja saaduste kontsentratsioonid samad. Seega ei ole tasakaal kummalegi poole nihutatud, mõlema reaktsiooni intensiivsus on sama, nagu allpool väljendatud:
Ärge lõpetage kohe... Peale reklaami on veel;)
2. juhtum: Reagentide kontsentratsioon, mis on suurem kui toodete kontsentratsioon:
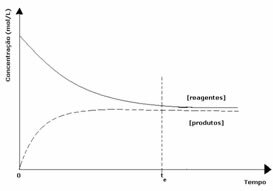
Sel juhul täheldatakse, et tasakaalu saavutamisel on reagentide kontsentratsioon suurem kui toodete kontsentratsioon. Seega järeldatakse, et kui reagenti on rohkem, toimub pöördreaktsioon suurema intensiivsusega. Reaktsioon nihutatakse vasakule:
3. juhtum: Reagentidest suurem toodete kontsentratsioon:
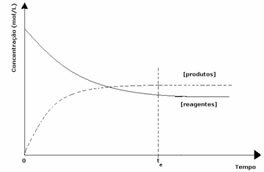
Kuna tasakaalus on toodete kontsentratsioon suurem, tähendab see, et reaktsioon on paremale, sest otsene reaktsioon (toodete moodustumisega) toimub suuremaga intensiivsus.
Mis näitab, kas reaktsioon kaldub paremale või vasakule, on tasakaalukonstant K, mis sõltub ainult temperatuurist.
Autor Jennifer Fogaça
Lõpetanud keemia
Brasiilia koolimeeskond
Kas soovite sellele tekstile viidata koolis või akadeemilises töös? Vaata:
FOGAÇA, Jennifer Rocha Vargas. "Keemilise tasakaalu graafiline uurimine"; Brasiilia kool. Saadaval: https://brasilescola.uol.com.br/quimica/estudo-grafico-equilibrio-quimico.htm. Juurdepääs 28. juunil 2021.
Keemia

Pange oma teadmised proovile ja õppige selle keemilise tasakaalu lahendatud harjutuste loendi abil lisateavet. Selle materjali kaudu saate paremini mõista, kuidas töötada tasakaalukonstandid (Kp, Kc ja Ki), tasakaalu muutus, pH ja pOH, samuti tasakaal nn puhverlahustes.