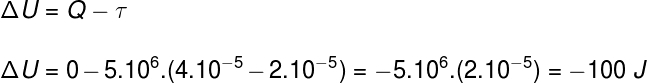Esimese termodünaamikaseaduse kohaselt on igas termodünaamilises protsessis soojushulk Q süsteemi poolt vastuvõetud on võrdne tema tehtud töö pluss selle sisemise energia variatsiooniga.
Kui rõhk on püsiv, kasutatakse süsteemi välise keskkonnaga vahetatavat soojust tööks ja siseenergia muutmiseks. Paljudes praktilistes olukordades allutatakse süsteeme atmosfäärirõhule, nagu keemilise reaktsiooni korral. Ülaltoodud joonis näitab seda tüüpi protsessi PV-diagrammi.
Sel juhul, esimese seaduse võrrandis,
Q = τ + ∆U
ükski termin pole null. Teos on kirjutatud mahu muutumise mahu V funktsioonina, näiteks:
τ = P.∆V
Ideaalse monoatoomse gaasi konkreetsel juhul võib energiat kirjutada järgmiselt:
Ärge lõpetage kohe... Peale reklaami on veel;)

Seetõttu võime kirjutada termodünaamika esimese seaduse funktsioonina ΔV:


Keskkonnaga vahetatav soojus on (5/2) P.ΔV ja 40% kogu kogusest - mis vastab P.ΔV-le - kasutatakse töö tegemiseks; ja (3/2) P.ΔV, mis vastab 60% -le koguenergiast, kasutatakse siseenergia muutmiseks. See tulemus kehtib ideaalse monoatomilise gaasi korral.
Kuumus on seotud temperatuuri kõikumisega (kasutades ideaalset gaasiseadust):

Seega saab tarnitud soojust arvutada temperatuuri muutuse või mahu muutuse järgi.
Autor Domitiano Marques
Lõpetanud füüsika
Kas soovite sellele tekstile viidata koolis või akadeemilises töös? Vaata:
SILVA, Domitiano Correa Marques da. "Esimene seadus isobaariliste protsesside jaoks"; Brasiilia kool. Saadaval: https://brasilescola.uol.com.br/fisica/primeira-lei-para-processos-isobaricos.htm. Juurdepääs 27. juunil 2021.