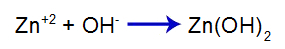
Kui me räägime pH, viidatakse lahuse hüdrogeenilisele potentsiaalile, see tähendab hüdrooniumkatioonide (H+ või H3O+), mis on dispergeeritud lahuse lahustis.
Hüdrooniumi katioonid on teadlase pakutud definitsiooni tõttu hästi tuntud Arhenius happe jaoks. See teadlane väidab seda hape on iga aine võimeline ioniseerima ja toota vesikeskkonnas hüdrooniumioone.

Happeioniseerimise võrrand
lühend pH toimib võrdlusena keskkonna happesuse taseme määramisel. Kuid pikka aega on keemikud kasutanud ka pH võrdlusena, et lisaks happesusele määrata, kas sööde on aluseline või neutraalne.
See on võimalik, sest keemikud on nüüd teadlikud, et vesi läbib eneseionisatsiooni, see tähendab, et see toodab hüdrooniume (H+) ja hüdroksiidid (OH-). Seega pole vesilahuses kunagi ainult hüdroonium või hüdroksiid, vaid mõlemad, nagu näeme järgmisest võrrandist:

Vee autoionisatsiooni võrrand
PH võrdlusandmetena kasutatavad väärtused
Väärtused, mida kasutatakse pH viitavad vee ionisatsioonikonstandile (Kw) temperatuuril 25 ° C
OC, mis on võrdne 10-ga-14. Sellel temperatuuril on vee tekitatud hüdroonium- ja hüdroksiidioonide kontsentratsioonid absoluutselt võrdsed, see tähendab 10-7 mol / l.[H+] = [OH-]= 10-7
Sellest võrdlusest alates on pH väärtuseks kasutatud väärtused vahemikus 0 kuni 14.
PH arvutamise valemid
a) Arvutamine hüdrooniumkatioonide kontsentratsiooni järgi mol / l
PH väärtuse saab arvutada otse, kui teame hüdrooniumide kontsentratsiooni ([H+]). Vaata:
pH = -log [H+]
või
10-H = [H+]
Ärge lõpetage kohe... Peale reklaami on veel;)
b) Arvutamine hüdroksiidanioonide (OH-)
pOH = -log [OH-]
või
10-OH = [OH-]
Pärast pOH väärtuse arvutamist peate seda pH väärtuse määramiseks kasutama järgmises avaldises.
pH + pOH = 14
PH väärtuste tõlgendamine
Teades pH väärtust, saame kindlaks teha, kas kõnealusel lahusel on happeline, aluseline või neutraalne iseloom. Selleks kasutage lihtsalt järgmist skemaatilist suhet:
Kui pH väärtus on alla 7 = happeline keskkond;
PH väärtusega 7 = neutraalne keskkond;
Kui pH väärtus on üle 7 = aluseline sööde.
Näited
1. näide: Teades, et hüdrooniumkatioonide kontsentratsioon lahuses on 2,10-4 mol / L, milline peaks olema selle lahuse pH väärtus?
Lahuse pH väärtuse määramine hüdrooniumide (H+), 2.10-4 mol / L, peame kasutama järgmist väljendit:
pH = -log [H+]
pH = -log [2,10-4 ]
pH = - (log 2 + log 10-4)
pH = -log2 - log10-4
pH = –log 2 - 4. log 10
pH = –0,3 + 4. (1)
pH = -0,3 + 4
pH = 3,7
2. näide: Teatud lahustunud aine lahuse hüdroksiidioonide kontsentratsioon on 10-11 mol / l. Selle kontsentratsiooni põhjal võime öelda, et selle lahuse pH on palju väärt?
Lahuse pH väärtuse määramiseks hüdroksiidi kontsentratsiooni põhjal 10-11 mol / L, peame tegema järgmist:
1O Samm: arvutage pOH väärtus.
10-OH = [OH-]
10-OH = 10-11
Peame avaldise korrutama -1-ga, kuna pOH on alati positiivne tundmatu.
-OH = -11. (- 1)
pOH = 11
2O Samm: arvutage pH väärtus.
pH + pOH = 14
pH + 11 = 14
pH = 14-11
pH = 3
Minu poolt. Diogo Lopes Dias
Kas soovite sellele tekstile viidata koolis või akadeemilises töös? Vaata:
PÄEVAD, Diogo Lopes. "Mis on pH?"; Brasiilia kool. Saadaval: https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-ph.htm. Juurdepääs 27. juunil 2021.
Keemia
Hüdroksüapatiidi mineraal, suu pH, hammaste lagunemine, hammaste korrosioon, fluoriidi perioodiline manustamine, suu tervis, suitsetamine ja hambad, hambaplekid, huulevähk, soolhape, buliimia, piimhape, pimsskivi, Sil