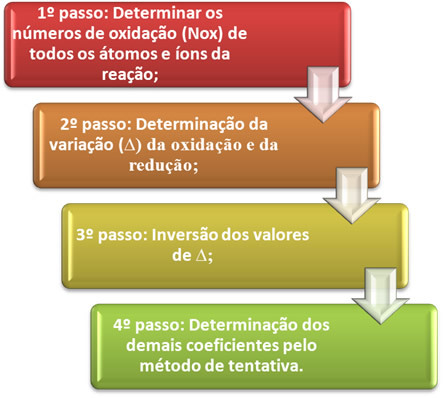
O tasakaalustades oksüdatsiooni-redutseerimise võrrandit see põhineb eraldatud elektronide ja vastuvõetud elektronide arvu võrdsusel. Selle balansseerimise lihtsaks meetodiks on järgmised sammud:
Vaatame praktikas, kuidas neid samme rakendada, kasutades järgmist näidet:
Reaktsioon kaaliumpermanganaadi vesilahuse ja vesinikkloriidhappe vahel:
kmnO4 + HCI → KCl + MnCl2 + Cl2 + H2O
*1. samm:Määrake oksüdatsiooninumbrid:
See samm on oluline, sest tavaliselt ei saa me kiiresti visualiseerida, millised liigid oksüdeeruvad ja redutseeruvad.
+1 +7 -2 +1 -1 +1 -1 +2 -1 0 +1 -2
kmnO4 + HCI → KCl + MnCl2 + Cl2 + H2O
*2. samm:Oksüdatsiooni ja redutseerimise variatsioonide määramine:

Pange tähele, et mangaan (Mn) redutseerub ja kloor (Cl) oksüdeerub.
MnCl2 = OxNox = 5
Cl2 = OxNox = 2
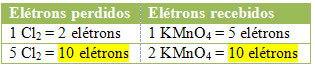
Kloori puhul võime märkida, et HCl andis 3 ühendit (KCl, MnCl2ja Cl2), kuid meid huvitab Cl2, sest just teie Nox on kannatanud variatsioonide all. Iga kloor, mis moodustab Cl2 kaotada 1 elektron; kuidas iga Cl moodustamiseks kulub 2 kloori2, siis kaotatakse kaks elektroni.
3. samm:∆ väärtuste teisendamine:
Selles etapis vahetatakse species väärtused mainitud liikide vahel, muutudes nende koefitsientideks:
MnCl2 = ∆Nox = 5 → 5 on Cl koefitsient2
Cl2 = ∆Nox = 2→ 2 on MnCl koefitsient2
kmnO4 + HCl → KCl + 2 MnCl2 + 5 Cl2 + H2O
Siinkohal on juba võimalik teada võrrandi kahte koefitsienti.
Tähelepanek: tavaliselt tehakse enamikus reaktsioonides see väärtuste ümberpööramine 1. liikmele. Kuid üldreeglina tuleks seda teha liikmeses, kus on kõige rohkem aatomeid, millel on redoks. Kui seda kriteeriumi ei saa täita, pöörame väärtused liikmele, kellel on kõige rohkem keemilisi liike. Siin tehti seda, kuna 2. liikmel on rohkem aineid.
4. samm: Proovide tasakaalustamine:
kmnO4 + HCl → KCl + 2 MnCl2 + 5 Cl2 + H2O
- Kuna teises liikmes on kaks mangaani aatomit, nagu näitab koefitsient, peavad esimeses ka olema. Nii et meil on:
2 kmnO4 + HCI → KCl + 2 MnCl2 + 5 Cl2 + H2O
- Seega oli kaaliumi (K) kogus esimeses liikmes 2, mis on sama aatomi koefitsient teises liikmes:
2 kmnO4 + HCI → 2 KCl + 2 MnCl2 + 5 Cl2 + H2O
- Kloori (Cl) kogus teises liikmes on kokku 16, seega on 1. liikme HCl koefitsient:
2 kmnO4 + 16 HCl → 2 KCl + 2 MnCl2 + 5 Cl2 + H2O
- 1. liikme vesinike arv on 16, seega ka vee koefitsient (H22. liikme O) võrdub 8-ga, kuna vesinikuindeksi (2) korrutamine 8-ga on võrdne 16-ga:
2 kmnO4 + 16 HCI → 2 KCl + 2 MnCl2 + 5 Cl2 + 8 H2O
- Võrrandi korrektseks tasakaalustamiseks näeme kahte kriteeriumi:
1.) Kontrollige, kas kahe aatomi kogus kahes liikmes on võrdne:
2 kmnO4 + 16 HCl →2 KCl + 2 MnCl2 + 5 Cl2 + 8 tundi2O
K = 2K = 2
Mn = 2 Mn = 2
Cl = 16 Cl = 16
H = 16 H = 16
O = 8 O = 8
2.) Vaadake, kas kadunud elektronide koguarv on võrdne vastuvõetud elektronide koguarvuga:
Autor Jennifer Fogaça
Lõpetanud keemia
Allikas: Brasiilia kool - https://brasilescola.uol.com.br/quimica/balanceamento-por-oxirreducao.htm
