Sulfoonimisreaktsioonid alkaanides nemad on orgaanilised asendusreaktsioonid, mis viidi läbi eesmärgiga toota sulfoonhapped (orgaanilised ühendid, millel on SO rühm3Süsinikuaatomi või süsinikuahela külge kinnitatud H) ja vee (H2O).
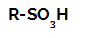
Sulfoonhappe struktuurivalem
Sulfoonimisreaktsiooni läbiviimiseks alkaanid, peame segama alkaani (ainult süsiniku ja vesiniku aatomitega küllastunud süsinikuahela ühend) ja väävelhape (H2AINULT4) kontsentreeritud, kuumutatud (∆).
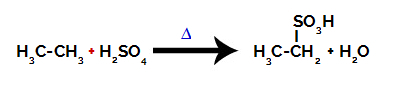
Keemiline võrrand, mis tähistab kahe süsinikusisaldusega alkaani sulfoonimist
Alkaanides sisalduva sulfoonimisreaktsiooni põhimõtted
Nagu näiteks alkaanisulfoonimisreaktsioon see on asendusreaktsioon, meil on selles vahetus väiksemate komponentide vahel elektronegatiivsus reagentidest, see tähendab alkaani ja väävelhappe vahel. Alkaanis on vesinik ja väävelhape - sulfoonrühm.
Allpool on meil sammhaaval a mehhanism sulfoonimisreaktsioon alkaanides. Näitena kasutame kõige lihtsamat alkaani, metaani (CH4):
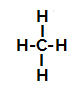
Metaani struktuurivalem
1. samm: Väävelhappes oleva hüdroksüül- (OH) ja väävli (S) vahelise sideme katkemine.
Iga väävelhappes leiduvat hüdroksüülrühma iseloomustab see, et see on rohkem elektronegatiivne. Reaktsiooni ajal kuumutades kipub hüdroksüülrühma ja väävli vaheline side katkema:
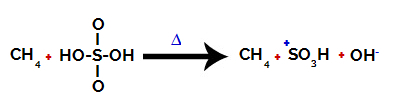
Väävli ja hüdroksüüli vahelise sideme katkemine
Kõigi hüdroksüülide sideme purunemist ei toimu siiski struktuuri elektroonilise ümberkorralduse tõttu. Seejärel saadakse hüdroksiidanioon (OH).-) ja sulfoonkatioon.
2. samm: Hüdroksüülrühma rünnak alkaanimolekuli vastu.
Seejärel hüdroksürühm (OH-) ründab alkaani, põhjustades süsiniku ja vesiniku vahelise sideme (mis on hapram, kuna nende vahel on erinev elektronegatiivsus) purunemine.
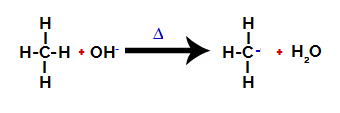
Alkaanis süsiniku ja vesiniku vahelise sideme purustamine
Märge: Süsiniku ja vesiniku vahelise sideme katkemine toimub alati kõige madalama elektroonilise tihedusega või väiksema laenguga süsinikul. Mida vähem on süsinikul vesinikke või mida rohkem on sellega seotud rühmi, seda väiksem on selle elektronitihedus. Nii et meil on:
Tertsiaarne süsinik
Pärast sideme purunemist muutub alkaan elektronpuudulikuks süsinikuks (karbokatsioon). Hüdroksiidrühm (OH)-) interakteerub vabanenud vesinikuga ja moodustab veemolekuli.
3. samm: Moodustunud radikaali rünnak sulfoonrühma suhtes.
Lõpuks ründab sulfoonrühma ülejäänud alkaan, moodustades sulfoonhappe.
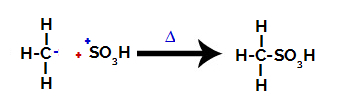
Struktuurid, mis suhtlevad ja moodustavad sulfoonhapet
Alkaanides sisalduvate sulfoonimisreaktsioonide esitamise võrrandite näited
1. näide: Propaani sulfoonimine.
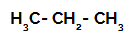
Propaani struktuurivalem
Propaanil on kaks primaarset süsinikku ja üks sekundaarset süsinikku, millel on erinevad laengud, kuna need on seotud erineva koguse vesinikuga. Kuna süsinik on rohkem elektronegatiivne kui vesinik, on nende süsinike elektronide tihedus erinev.
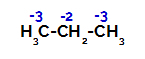
Laengute jaotus propaani igale süsinikuaatomile
Primaarsete süsinike korral on laeng -3 (kuna see on seotud kolme vesinikuga) ja sekundaarsel süsinikul on laeng -2 (kuna see on seotud kahe vesinikuga). Seega tekib süsiniku ja vesiniku vahelise sideme katkemine, mõnikord süsiniku 1 (ühe molekuli), mõnikord süsiniku 2 (teise molekuli) juures.
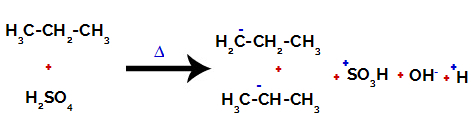
Süsiniku ja vesiniku vahelise sideme purustamine erinevatel süsinikel
Pärast sidemete purunemist nii väävelhappes kui ka alkaanis moodustub tooted vesiniku asendamisel süsinikul 1 sulfoonrühmaga ja sama toimub ka süsinikul 2.
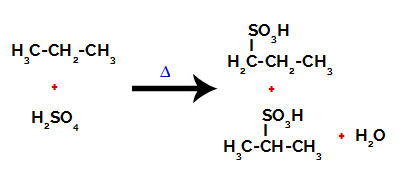
Propaani sulfoonimisel saadud tooted
2. näide: 2-metüülbutaani sulfoneerimine.

2-metüülbutaani struktuurivalem
2-metüülbutaanil on kolm peamist süsinikku, sekundaarne süsinik ja tertsiaarne süsinik erinevad laengud ja sellest tulenevalt erinevad elektroonilised tihedused, nagu võib näha järgmisest struktuurist:
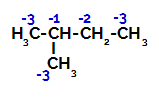
Elektrooniliste laengute jaotus 2-metüülbutaanis
Seetõttu on 2-metüülbutaanis mitu võimalust süsiniku ja vesiniku vahelise sideme purustamiseks, mis võib esineda süsinikul 1 (molekulil), süsinikul 2 (teisel molekulil), süsinikul 3 või süsinikul 4. Tähelepanuväärne on aga see, et süsinikuarv 2 juures esinevad häired sagedamini.
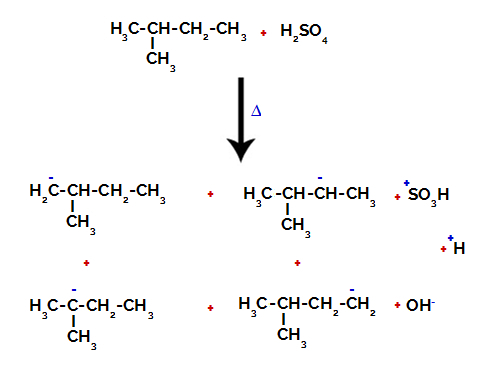
Süsiniku ja vesiniku vahelise sideme purustamine erinevatel süsinikel
Pärast sidemete vahelisi purunemisi nii väävelhappes kui ka alkaanis moodustub tooted süsiniku 1 vesiniku asendamisega sulfoonrühmaga ja sama juhtub ka süsinik 2.

2-metüülbutaani sulfoonimisel saadud tooted
Minu poolt. Diogo Lopes Dias
Allikas: Brasiilia kool - https://brasilescola.uol.com.br/quimica/reacoes-sulfonacao-alcanos.htm
