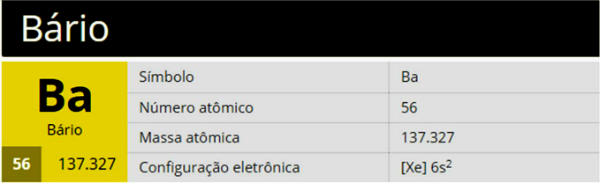
Baarium on keemiline element sümboliga Ba, aatomnumber 56 ja aatommass 137 327, mis kuulub perioodilisustabeli rühma 2 (perekond 2A), olles leelismuldmetall.
Selle nimi tuleneb kreeka keelest barys ja see tähendab rasket.
Funktsioonid
Toatemperatuuril on see tahke olekus, pehme konsistentsi ja hõbedase värvusega. Kuid looduses seda puhtal kujul ei leidu, kuna see on õhuga kokkupuutel kergesti oksüdeeruv.
Baariumi leidub bariidimaagides (BaSO4) ja vutiit (BaCO3). Nende maagide peamised kaevandusalad on Ühendkuningriigis, Itaalias, Tšehhi Vabariigis, USA-s ja Saksamaal.
Baariumil on kõrge sulamistemperatuur (1000 K - 727 ° C) ja keemistemperatuur (2170 K - 1897 ° C). See on endiselt hea elektrijuht.
See on vee ja alkoholiga kokkupuutel väga reaktiivne. Selle reaktsioon veega tekitab hüdroksiidi ja eraldub vesinik.
Lahustuvad baariumühendid on organismile mürgised. Vaatamata vees ja toidus leiduvale baariumikogusele ei piisa terviseprobleemide tekitamiseks.
Suure oksüdeerimisvõime tõttu peab baarium säilima mineraalõlis.
Lisateave, lugege ka:
- Keemilised elemendid
- Perioodilisustabel
rakendused
Baariumi peamiste rakenduste hulka kuuluvad:
- Puhtal kujul kasutatakse seda hapniku eemaldamiseks elektroonilistest ventiilidest;
- Rotimürk baariumkarbonaadi kujul;
- Kasutatakse värvides valge pigmendina;
- Klaasi tootmine;
- Baarium sulfaati kasutatakse vedelikuna nafta- ja gaasipuuraukude puurimisel;
- Baariumkloraati ja -nitraati kasutatakse rohelise leegi tootmiseks pürotehnilistes rakettides;
- Baarium sulfiid suurendab seedetrakti röntgenuuringute kontrastsust ja seda manustatakse patsientidele suu kaudu. Allaneelamine ei põhjusta terviseprobleeme, kuna aine ei lahustu, ei kogune ja eritub organismist kiiresti;
Kuigi baarium sulfiid on kahjutu, on baariumkarbonaat äärmiselt mürgine ja võib lõppeda surmaga. Joobeseisundis inimesel on hingamisraskused, oksendamine, värisemine, tahhükardia, vererõhu tõus ja süljeeritus.
Samuti võite olla huvitatud:
- Metallist lingid
- Vask
- Liitium